Nat. Prod. Bioprospect. DOI 10.1007/s13659-014-0013-7
Elmar Breuer
Tierärztliche Klinik für Haustiere, Müllheim/Baden, Deutschland
Thomas Efferth
Abteilung für Pharmazeutische Biologie, Institut für Pharmazie und Biochemie, Johannes Gutenberg-Universität Mainz, Deutschland
Erhalten 25. Februar 2014
Angenommen 1. April 2014
Die Autoren 2014. Dieser Artikel wird mit freiem Zugang bei Springerlink.com veröffentlicht.
Alle verwendeten Quellen werden als [1, 2, usw.] dargestellt. Sie finden diese unten im Quellenverzeichnis.
Zusammenfassung: Artemisinin, ein Bestandteil von Artemisia annua L., ist ein bekanntes Malariamittel. Medikamente vom Artemisinin-Typ hemmen auch das Krebswachstum in vitro und in vivo. Kräuterextrakte von A. annua hemmen das Wachstum von Krebszelllinien. Hier berichten wir über die Verwendung von Kapseln mit Pulver von Herba Artemisiae annuae zur Behandlung von Haustiersarkomen. Die chirurgische Tumorentfernung als Standardbehandlung wurde durch eine adjuvante Therapie mit A. annua ergänzt. Eine Katze und ein Hund mit Fibrosarkom überlebten 40 bzw. 37 Monate ohne Tumorrezidiv. Zwei weitere Hunde mit Fibrosarkom und Hämangioendothelsarkom zeigten ebenfalls eine vollständige Remission und sind nach 39 bzw. 26 Monaten noch am Leben. A. annua wurde ohne nennenswerte Nebenwirkungen gut vertragen. Diese vier Fälle deuten darauf hin, dass A. annua ein vielversprechendes pflanzliches Arzneimittel für die Krebstherapie sein könnte.
Schlüsselwörter Artemisinin _ Asteraceae _ Scopoletin _ Veterinärkrebs _ Vergleichende Onkologie
1 Einleitung
Artemisia annua L. ist eine Heilpflanze, die in der traditionellen chinesischen Medizin zur Behandlung von Fieber und Schüttelfrost verwendet wird. In den späten 1960er und 1970er Jahren entdeckten chinesische Wissenschaftler, dass Artemisinin, einer der Bestandteile von A. annua, gegen Malaria wirksam ist [1, 2]. Die malariabekämpfende Wirkung von Artemisinin wurde von vielen Wissenschaftlern weltweit bestätigt. Heute sind Derivate von Artemisinin wie Artemether und Artesunat gut etablierte Medikamente im Kampf gegen Malaria. In den 1990er Jahren zeigten die Pionierarbeiten von uns und anderen, dass Artemisinin und seine Derivate das Krebswachstum in vitro hemmen [3-7]. In den folgenden Jahren stellte sich heraus, dass Verbindungen vom Artemisinin-Typ in der Lage sind, Zelllinien vieler verschiedener Tumorarten abzutöten, z.B. Leukämie, Lymphome, Melanome, Hirntumore, Dickdarm-, Brust-, Eierstock-, Lungen-, Nierenkarzinome und viele andere [8-10]. Untersuchungen der Wirkungsweise ergaben, dass Artemisinin aktive radikalische Sauerstoffspezies und kohlenstoffzentrierte Radikalmoleküle bilden kann, die zu oxidativem Stress [11-15], DNA-Schäden [16, 17], Adduktbildung spezifischer Zielproteine [18, 19], Zellzyklus-Arrest [20], Interaktion mit Signaltransduktionswegen [21-26], Induktion von Apoptose und Autophagie [7, 27-31] und Hemmung der Angiogenese [32-35] führen können. Artemisinin-ähnliche Medikamente wirken auch in vivo gegen Krebs bei transplantierbaren syngenen Tumoren der Maus [6, 36-38] und bei menschlichen Xenotransplantationstumoren [32, 39-47]. Die klinische Wirksamkeit wurde in mehreren Berichten über den Einsatz dieser Substanzen [48, 49] und in jüngerer Zeit in klinischen Studien bei Tumoren in der Tiermedizin (spontane Tumoren bei Hunden) und beim menschlichen Gebärmutterhalskrebs [50, 51] beschrieben.
Während Artemisinin und seine Derivate sowohl bei Malaria als auch bei Krebs gut analysiert sind, ist über die Bioaktivität von Pflanzenextrakten von A. annua weniger bekannt. Die antimalariaverstärkende Wirkung von A. annua-Tee oder -Extrakten ist in Tierversuchen untersucht worden [52, 53]. Die Malariabehandlung mit A. annua-Tee ist in Afrika in der einheimischen Bevölkerung außerhalb der offiziellen Gesundheitssysteme weit verbreitet [54-60]. Ob Herba Artemisiae annuae in vivo gegen Krebs wirksam ist oder nicht, ist unbekannt, obwohl über zytotoxische Aktivität in vitro berichtet wurde [61, 62].
Hier berichten wir über die Verwendung von Herba A. annuae bei an Sarkom erkrankten Haustieren. Hunde und Katzen können spontan Krebs entwickeln, was sie zu geeigneten Probanden für eine pharmakologische Intervention macht [63]. Die Behandlung von Tumoren bei drei Hunden und einer Katze zeigte eine beträchtliche Reaktion von Tumoren auf das pflanzliche Präparat.
2 Ausgangsstoffe und Methoden
2.1 Ausgangsstoffe
Artemisia annua L.-Präparate (LupArte®) wurden von der LupoVet GmbH (Müllheim/Baden, Deutschland) bezogen. Mit einem halbautomatischen Gerät wurden 450 bzw. 150 mg der im Verhältnis 1:30 extrahierten und pulverisierten Herba A. annuae aus technischen Gründen mit 50 bzw. 17 mg Inulin angereichert und in Kapseln der Größe “O“ bzw. “4“ eingeschlossen.
2.2 Dünnschicht-Chromatographie (TLC)
Die Methode wurde wie beschrieben mit Modifikationen durchgeführt [64]. Die Testlösung wurde durch ein Auflösen von 3 g Herba A. annuae Pulver in 50 ml Petrolether (vorgewärmt auf 60-90 °C), Rückfließen für 1 h und Filtrieren hergestellt. Das Filtrat wurde zur Trocknung eingedampft und der entstandene Rückstand in 30 ml Hexan gelöst. Die Lösung wurde zweimal oder dreimal mit 20 % Acetonitril-Wasser getrennt und die kombinierten Acetonitril-Phasen wurden bis zur Trocknung eingedampft. Der verdampfte Trockenrückstand wurde in 0,5 ml Ethanol gelöst. Als Referenzsubstanzen wurden Artemisinin und Scopoletin (je 1 mg/ml) verwendet (Sigma-Aldrich, Taufkirchen, Deutschland).
Die Dünnschichtchromatographie wurde mit Kieselgel-60-F254-Platten (Merck, Darmstadt, Deutschland) durchgeführt, auf die jeweils 5 µL Testlösung und Referenzsubstanzen aufgetragen wurden. Die Platten wurden in einem Chromatographiegefäß entwickelt, das eine mobile Phase enthielt, die aus Cyclohexan/Ethylacetat/Eisessig im Verhältnis 20:10:1 bestand. Nach der Entwicklung wurde die Platte luftgetrocknet, unter Tageslicht und UV-Licht (365 nm) untersucht und mit einem Sprühreagenz besprüht, das aus 5 ml Anisaldehyd, 10 ml Eisessig gemischt mit 85 ml Methanol und konzentriertem H2SO4 bestand.
2.3 Patienten
Bei einer Hündin und zwei Rüden sowie einem Kater im Alter zwischen 10 und 13 Jahren wurde an der Veterinärklinik Müllheim ein Hämangioendothelsarkom oder Fibrosarkom diagnostiziert. Alle vier Tiere litten bei der Diagnose an einem Tumor Grad 3 oder 4 (Tabelle 1).
Nachdem die Entscheidung für LupArte® getroffen worden war, wurde der Serumeisengehalt (normaler Bereich zwischen 140 und 170 µg/dL) gemessen. Zwischen der Blutentnahme und dem Erhalt der Serumeisenresultate aus dem klinischen Diagnoselabor wurde das Eisen alle 3 Tage oral zweimal täglich oder intramuskulär verabreicht, um die eisenaffinen malignen Zellen zu markieren. Die anfängliche “blinde“ Dosis oral verabreichten Eisens (z.B. Ferrosanol® Kapseln 100 mg) betrug etwa 100 mg/30 kg zweimal täglich oder intramuskulär etwa 100 mg/10 kg Gewicht Ursoferran zweimal wöchentlich. Die Eisenapplikation wurde während der gesamten Behandlungszeit fortgesetzt und war darauf abgestimmt, den Eisenspiegel bei 250 ± 30 µg/dL zu halten.
Ab dem vierten Tag wurden die Tiere oral zwei- bis dreimal täglich mit einer Kapsel (150 mg bei der Katze, 450 mg bei den Hunden) Herba A. annuae gleichzeitig behandelt.
Tabelle 1 Klinische Daten der Tiere
| Fall 1 | Fall 2 | Fall 3 | Fall 4 | |
| Art | Katze | Hund | Hund | Hund |
| Rasse | Europäische | Berner Sennenhund | Gordon Setter | Berner Sennenhund |
| Geschlecht | männlich | männlich | weiblich | männlich |
| Datum der Diagnose |
14.09.2011 | 28.12.2011 | 18.10.2011 | 25.11.2011 |
| Alter bei der Diagnose |
10 Jahre | 10 Jahre | 10 Jahre | 10 Jahre |
| Anfänglicher Serum-Eisengehalt (µg/dL) |
222 | 107 | 85 | 124 |
| Histologie | Fibrosarkom | Fibrosarkom | hämangioendotheliales Sarkom | Fibrosarkom |
| Staging-Gradierung | T3N0M0 | T3NxM0 | T4N0M0 | T3NxM0 |
| Antwort | Vollständiger Erlass | Vollständiger Erlass | Vollständiger Erlass | Vollständiger Erlass |
| Überlebenszeit (Monate) | 40a | 37a | 39a | 26a |
| Status | tot | tot | lebendig | lebendig |
a am 10. Februar 2014
3 Ergebnisse
3.1 Dünnschicht-Chromatographie
Als Ausgangspunkt analysierten wir die Zusammensetzung des A. annua-Pulvers, das für die Herstellung der LupArte®-Kapseln verwendet wurde, mittels TLC. Wie in Abb. 1 gezeigt, war Artemisinin ein Nebenbestandteil mit einem Rf-Wert, der dem Rf der authentischen Probe ähnelt, und Scopoletin war der Hauptbestandteil des A. annua-Pulvers. Mit diesem Pflanzenpulver gefüllte Kapseln wurden für die Therapie von Tieren, die an Sarkom erkrankt waren, in einer adjuvanten Umgebung zusammen mit einer ersten Operation verwendet.
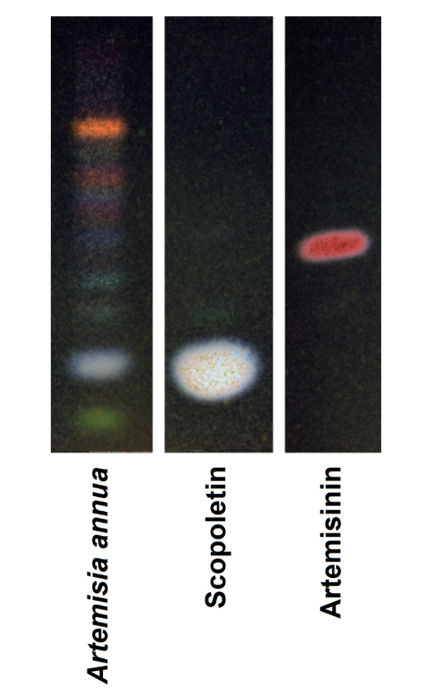
Abbildung 1: Dünnschichtchromatographie von Herba Artemisiae Annuae (LupArte®). Scopoletin und Artemisinin wurden als Referenzverbindung verwendet
3.2 Fall 1
Bei einer 10 Jahre alte Katze wurde am 14. September 2011 ein hochmalignes Fibrosarkom diagnostiziert, das subkutan an der unteren Vorderflanke lokalisiert war, Muskeln und Fettgewebe infiltrierte und in die Venen eindrang (Abb. 2a; Tabelle 1). Der Tumor neigte nicht zu einer kapselartigen Morphologie und zeigte marginale Faserbildung. Eine begleitende Entzündung mit lymphoplasmazellulärer Dominanz und lymphofollikulärer Proliferation waren nachweisbar. Der Tumor wurde operativ entfernt und adjuvant mit A. annua (3 Kapseln 150 mg/Tag) wegen hoher Serum-Eisenwerte ohne Eisenapplikation behandelt. Es wurden keine Nebenwirkungen beobachtet. Die Euthanasie wurde 40 Monate später, am 7. Januar 2014, wegen chronischer Hepatose durchgeführt. Der Tumor war zu diesem Zeitpunkt weder klinisch noch sonographisch nachweisbar.
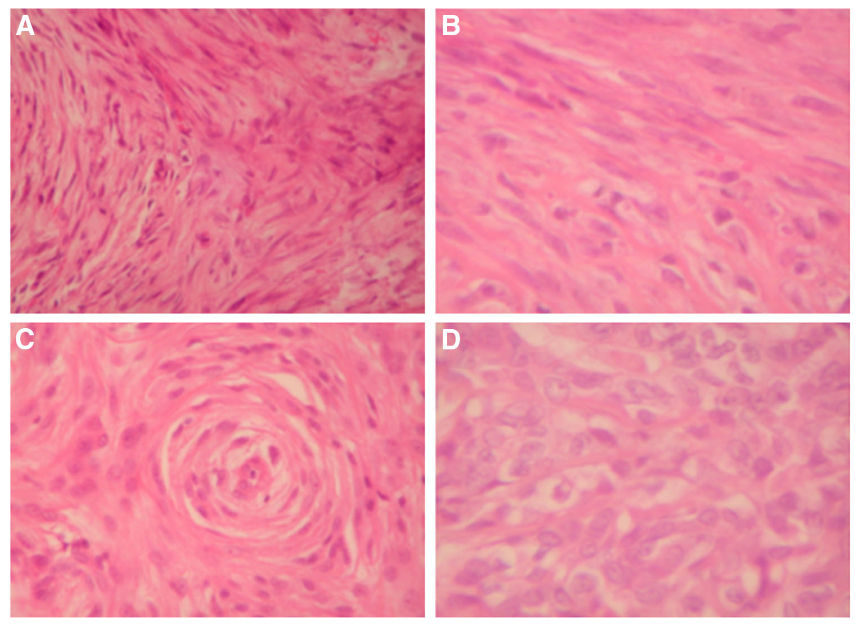
Abbildung 2
Histologie der Haustiersarkome
a Hochmalignes Fibrosarkom der Katze Fall 1 (x 400)
b Fibrosarkom des Berner Sennenhundes Fall 2 (x 600)
c Hemangiosarkom des Berner Sennenhundes Fall 3 (x 400)
d Fibrosarkom des Berner Sennenhundes Fall 4 (x 600)
3.3 Fall 2
Am 28. Dezember 2010 wurde bei einem 10 Jahre alten Hund (Berner Sennenhund-Mix) eine bukkal lokalisierte, hochmaligne mesenchymale Neoplasie hauptsächlich fibrosarkomatöser Architektur diagnostiziert (Abb. 2b; Tabelle 1). Der stark proliferierende Tumor zeigte eine tuberöse Infiltration. Bereiche mit Fibroblastenproliferation waren von Kapillarsprossen durchsetzt. Eine massive plasmazelluläre neutrophile Entzündung mit einem hohen Anteil an Mastzellen überlagerte den Tumor. Der Tumor wurde operativ unvollständig entfernt und ab dem vierten Tag nach Markierung der bösartigen Zellen mit Eisen aus den Ferrosanol 100 mg Kapseln mit A. annua (2 Kapseln 450 mg/Tag) adjuvant behandelt. Es wurden keine Nebenwirkungen beobachtet. Der Hund wurde 37 Monate später, am 20. März 2012, wegen Urämie eingeschläfert. Zu diesem Zeitpunkt wurde kein Tumorrezidiv festgestellt.
3.4 Fall 3
Bei einem 10-jähriger Gordon Setter mit einem klinisch offensichtlichen Brustkrebs mit einer Länge von etwa 40 cm und einer Breite von etwa 10 cm wurde am 18. Oktober 2010 ein hochakuter Verlauf und eine massive ödematöse Entzündung diagnostiziert. Der Tumor wurde als hämangioendotheliales Sarkom mit multiplen Foci diagnostiziert (Abb. 2c; Tabelle 1). Teilweise fand eine Kapselbildung statt. Die Tumorherde zeigten infiltrierende fibrotische Knoten. Zwei Abschnitte von Lymphknoten mit Hämosiderose wiesen keine Metastasen auf. Der Tumor wurde operiert und mit A. annua (LupArte®) (3 Kapseln à 450 mg/Tag) ab dem vierten Tag adjuvant behandelt, nachdem der Eisennachweis die verbleibenden bösartigen Zellen markiert hatte. Die Artemisia-Kapseln wurden ohne Nebenwirkungen gut vertragen. Neununddreißig Monate später, Mitte Januar 2014, erfuhren wir durch einen Telefonanruf, dass es dem Hund gut geht.
3.5 Fall 4
Bei einem 10 Jahre alten Berner Sennenhund wurde am 25. November 2011 ein rasch wachsender, unregelmäßig begrenzter Tarsaltumor diagnostiziert. Die pathologische Untersuchung ergab, dass es sich bei dem Tumor um ein hochmalignes Fibrosarkom handelte, das in Fettgewebe und Fettgewebe und in die Venen eindrang (Abb. 2d; Tabelle 1). Der Tumor bildete keine Kapsel und zeigte marginale Faserbildung. Eine begleitende Entzündung mit Lymphoplasmazelldominanz und lymphofollikulärer Proliferation war nachweisbar. Das Fibrosarkom wurde chirurgisch entfernt; auf den verbleibenden Defekt wurde ein Hautgeflecht transplantiert und der Hund wurde etwa 2 Jahre lang zweimal täglich mit Kapseln zu je 450 mg behandelt. Es traten keine Nebenwirkungen auf. Sechsundzwanzig Monate später ist der Hund immer noch gesund, ohne Anzeichen eines Rückfalls.
4 Diskussion
In der vorliegenden Untersuchung beschäftigten wir uns mit der Frage, ob ein A. annua-Präparat in der Lage ist, Tumore in vivo zu hemmen oder nicht. Dieses Projekt wurde durch von uns und anderen erhobene Daten inspiriert, die darauf hinwiesen, dass A. annua-Extrakte in Kombination mit isoliertem Artemisinin Krebszellen in vitro hemmen können[5, 61, 65]. Dennoch bleibt die Frage, ob die in vitro beobachtete zytotoxische Aktivität auf lebende Organismen übertragen werden kann oder nicht. In vielen Fällen ist dies ungewöhnlich. Die Beobachtungen, die wir mit einem 1:30 A. annua-Extrakt zur Behandlung von spontanen Tumoren und bei Hunden und Katzen gemacht haben, sind ermutigend für den Beginn größerer placebokontrollierter und randomisierter klinischer Studien. Fibrosarkom und Hämangioendothelsarkom sind Tumorarten, die primär durch chirurgische Entfernung behandelt werden. Die Überlebenszeit von Hunden mit einem operativ behandelten Fibrosarkom liegt zwischen 7 und 12,2 Monaten. Eine zusätzliche adjuvante Strahlentherapie verbesserte die Ergebnisse um durchschnittlich 743 Tage [68]. Die Strahlentherapie von Sarkomen bei Hunden führte zu Überlebenszeiten zwischen 8 und 19,7 Monaten [69-74], während der Erfolg der Chemotherapie begrenzt ist [75]. Dies ist eine unbefriedigende Situation, und neue Behandlungsstrategien sind dringend erforderlich. Hier berichten wir über vier Haustiere, die an einem Fibrosarkom oder Hämangiosarkom erkrankt waren, das mit einer Operation plus A. annua-Kapseln behandelt wurde, nachdem die verbleibenden bösartigen Zellen mit Eisen markiert worden waren. Die kombinierte Anwendung von Operation und adjuvanter Behandlung mit Eisen und A. annua führte zu Überlebenszeiten zwischen 26 und 40 Monaten, und zwei der vier Tiere sind noch am Leben. Dies deutet darauf hin, dass eine adjuvante Behandlung mit Eisen und A. annua die Gesamtüberlebensrate von Hunden, die an einem Sarkom leiden, beeinflusst und den Behandlungserfolg gegenüber der alleinigen Operation verbessert. Kontrollierte klinische Studien sind gerechtfertigt, um diese ersten Erfahrungen mit eisengetriggerter A. annua in der Krebstherapie bei Haustieren zu verifizieren. Die vergleichende Relevanz dieser phytochemischen Studie für die Humanonkologie bleibt abzuwarten. Bis jetzt ist den Autoren keine vergleichbare Alternative bekannt.
Während große Anstrengungen unternommen werden, Medikamente in vivo an Mäusen zu testen, wird der Wert von Tumoren in der Tiermedizin als vergleichender in vivo-Test häufig unterschätzt. Am häufigsten werden syngenische oder humane Xenotransplantationstumoren bei Mäusen verwendet, um die Aktivität zytotoxischer Verbindungen in vivo zu testen. Beide Modellsysteme haben Vor- und Nachteile [66]. Syngenetische und Xenotransplantationstumoren sind leicht zu erhalten, und es stehen gut etablierte Tumorlinien zur Verfügung. Sie werden in der Regel intraperitoneal oder subkutan erhalten, aber dies sind Stellen, die für die klinische Situation möglicherweise nicht relevant sind. Darüber hinaus werden humane Xenotransplantate in athymische Nacktmäuse transplantiert, denen ein intaktes Immunsystem fehlt. Relevantere Tumormodelle wie orthotope Tumore erfordern eine chirurgische Manipulation und sind daher zeit- und kostenaufwendig. Zudem benötigen die Tiere mehr Pflege. Daher können experimentell induzierte oder spontan auftretende tierärztliche Tumore eine vielversprechende Option darstellen [63, 66, 67]. Unsere eigenen Erfahrungen mit A. annua und kürzlich publizierte Daten mit Artesunat bei Hundetumoren [51] sprechen dafür, dass tierärztliche Tumore ein geeignetes Modell sind, um die krebsbekämpfende Wirkung von Medikamenten in vivo zu testen, bevor sie bei menschlichen Krebspatienten angewendet werden. Auf diese Weise liefern solche Studien eine „vergleichende Onkologie“. Ein interessantes Ergebnis war, dass Artemisinin nur einen kleinen Bestandteil in A. annua darstellte und dass Scopoletin die am häufigsten vorkommende Phytochemikalie war. Es ist bekannt, dass A. annua eine große Anzahl verschiedener Sekundärmetaboliten, einschließlich Scopoletin, enthält, die zytotoxisch sind [5, 57, 76-79]. Die Aktivität des A. annua-Präparats bei Tumoren von Haustieren und das Vorhandensein großer Mengen von Scopoletin werfen die Frage auf, ob Scopoletin eher zur krebsbekämpfenden Wirkung dieser Pflanze als Artemisinin beitragen könnte. Die In-vitro-Zytotoxizität von Scopoletin gegenüber Krebszellen wurde bereits früher beschrieben [80-82].
Zusammenfassend geben die Ergebnisse der vorliegenden Untersuchung Anlass zur Hoffnung, dass Ansätze mit A. annua für die Behandlung von Tumoren in der Tiermedizin vielversprechend sein könnten. Darüber hinaus verdient die Analyse von Scopoletin und anderen hydroxylierten und methoxylierten Flavonoiden als therapeutisches Prinzip bei A. annua weitere Aufmerksamkeit.
Danksagungen Die technische Assistenz von Frau Doris Rohr und die Sekretariatsunterstützung von Frau Ilona Zirbs werden dankbar anerkannt. Wir sind Karen Duffy (Cornell University, Ithaca, NY, USA) für die kritische Lektüre des Manuskripts zu Dank verpflichtet.
Open Access Dieser Artikel wird unter den Bedingungen der Creative Commons Attribution License verbreitet, die jede Nutzung, Verbreitung und Vervielfältigung in jedem Medium erlaubt, sofern der/die Originalautor(en) und die Quelle angegeben werden.
Referenzen
1. D.L. Klayman, Science228, 1049–1055 (1985)
2. T. Efferth, Planta Med.73, 299–309 (2007)
3. W.S. Sun, J.X. Han, W.Y. Yang, D.A. Deng, X.F. Yue, ActaPharmacol. Sin.13, 541–543 (1992)
4. H.J. Woerdenbag, T.A. Moskal, N. Pras, T.M. Malingre, F.S. el-Feraly, H.H. Kampinga, A.W. Konings, J. Nat. Prod.56, 845–849(1993)
5. G.Q. Zheng, Planta Med.60, 54–57 (1994)
6. J.C. Moore, H. Lai, J.R. Li, R.L. Ren, J.A. McDougall, N.P.Singh, C.K. Chou, Cancer Lett.98, 83–87 (1995)
7. T. Efferth, G. Ru ̈cker, M. Falkenberg, D. Manns, A. Olbrich, U.Fabry, R. Osieka, Arzneim. Forsch.46, 196–200 (1996)
8. T. Efferth, H. Dunstan, A. Sauerbrey, H. Miyachi, C.R. Chi-tambar, Int. J. Oncol.18, 767–773 (2001)
9. T. Efferth, Drug Resist. Updat.8, 85–97 (2005)
10. T. Efferth, Curr. Drug Targets7, 407–421 (2006)
11. T. Efferth, M.M. Briehl, M.E. Tome, Int. J. Oncol.23, 1231–1235(2003)
12. T. Efferth, F. Oesch, Biochem. Pharmacol.68, 3–10 (2004)
13. T. Efferth, A. Benakis, M.R. Romero, M. Tomicic, R. Rauh, D.Steinbach, R. Ha ̈fer, T. Stamminger, F. Oesch, B. Kaina, M.Marschall, Free Radic. Biol. Med.37, 998–1009 (2004)
14. G. Kelter, D. Steinbach, V.B. Konkimalla, T. Tahara, S. Taketani,H.H. Fiebig, T. Efferth, PLoS One2, e798 (2007)
15. T. Efferth, M. Volm, In Vivo.19, 225–232 (2005)
16. P.C. Li, E. Lam, W.P. Roos, M.Z. Zdzienicka, B. Kaina, T.Efferth, Cancer Res.68, 4347–4351 (2008)
17. N. Berdelle, T. Nikolova, S. Quiros, T. Efferth, B. Kaina, Mol.Cancer Ther.10, 2224–2233 (2011)
18. T. Eichhorn, S. Schloissnig, B. Hahn, A. Wendler, R. Mertens,W.D. Lehmann, R.L. Krauth-Siegel, T. Efferth, Mol. BioSyst.8,1311–1318 (2012)
19. T. Eichhorn, D. Winter, B. Bu ̈chele, N. Dirdjaja, M. Frank, W.D.Lehmann, R. Mertens, R.L. Krauth-Siegel, T. Simmet, J. Granzin,T. Efferth, Biochem. Pharmacol.85, 38–45 (2013)
20. L. Steinbrück, G. Pereira, T. Efferth, Cancer Genomics Proteo-mics7, 337–346 (2010)
21. T. Efferth, A. Olbrich, R. Bauer, Biochem. Pharmacol.64,617–623 (2002)
22. T. Efferth, A. Sauerbrey, A. Olbrich, E. Gebhart, P. Rauch, H.O.Weber, J.G. Hengstler, M.E. Halatsch, M. Volm, K.D. Tew, D.D.Ross, J.O. Funk, Mol. Pharmacol.64, 382–394 (2003)
23. V.B. Konkimalla, M. Blunder, B. Korn, S.A. Soomro, H. Jansen,W. Chang, G.H. Posner, R. Bauer, T. Efferth, Nitric Oxide19,184–191 (2008)
24. V.B. Konkimalla, J.A. McCubrey, T. Efferth, Curr. Cancer DrugTargets9, 72–80 (2009)
25. S. Sertel, T. Eichhorn, C.H. Simon, P.K. Plinkert, S.W. Johnson,T. Efferth, Molecules15, 2886–2910 (2010)
26. B. Bachmeier, I. Fichtner, P.H. Killian, E. Kronski, U. Pfeffer, T.Efferth, PLoS One6, e20550 (2011)
27. T. Efferth, M. Giaisi, A. Merling, P.H. Krammer, M. Li-Weber,PLoS One2, e693 (2007)
28. M. Ramacher, V. Umansky, T. Efferth, Anticancer Drugs20,910–917 (2009)
29. S. Sieber, G. Gdynia, W. Roth, B. Bonavida, T. Efferth, Int.J. Oncol.35, 149–158 (2009)
30. A. Hamacher-Brady, H.A. Stein, S. Turschner, I. Toegel, R.Mora, N. Jennewein, T. Efferth, R. Eils, N.R. Brady, J. Biol.Chem.286, 6587–6601 (2011)
31. S. Reichert, V. Reinboldt, S. Hehlgans, T. Efferth, C. Ro ̈del, F.Ro ̈del, Radiother. Oncol.103, 394–401 (2012)
32. R. Dell’Eva, U. Pfeffer, R. Vene ́, L. Anfosso, A. Forlani, A.Albini, T. Efferth, Biochem. Pharmacol.68, 2359–2366 (2004)
33. L. Anfosso, T. Efferth, A. Albini, U. Pfeffer, PharmacogenomicsJ.6, 269–278 (2006)
34. S. Soomro, T. Langenberg, A. Mahringer, V.B. Konkimalla, C.Horwedel, P. Holenya, A. Brand, C. Cetin, G. Fricker, M. De-werchin, P. Carmeliet, E.M. Conway, H. Jansen, T. Efferth, J.Cell Mol. Med.15, 1122–1135 (2011)
35. B. Krusche, J. Arend, T. Efferth, Evid. Based Complement.Alternat. Med. 454783 (2013)
36. H.J. Zhou, J.L. Zhang, A. Li, Z. Wang, X.E. Lou, Cancer Che-mother. Pharmacol.66, 21–29 (2010)
37. N.P. Singh, H.C. Lai, J.S. Park, T.E. Gerhardt, B.J. Kim, S.Wang, T. Sasaki, Anticancer Res.31, 4111–4114 (2011)
38. S. Noori, Z.M. Hassan, Cell. Immunol.271, 67–72 (2011)
39. J. Hou, D. Wang, R. Zhang, H. Wang, Clin. Cancer Res.14,5519–5530 (2008)
40. T. Chen, M. Li, R. Zhang, H. Wang, J. Cell Mol. Med.13,1358–1370 (2009)
41. H. Chen, B. Sun, S. Pan, H. Jiang, X. Sun, Anticancer Drugs20,131–140 (2009)
42. J.H. Du, H.D. Zhang, Z.J. Ma, K.M. Ji, Cancer Chemother.Pharmacol.65, 895–902 (2010)Artemisia annuafor Pet Sarcoma
43. N. Gao, A. Budhraja, S. Cheng, E.H. Liu, C. Huang, J. Chen, Z.Yang, D. Chen, Z. Zhang, X. Shi, Apoptosis16, 511–523 (2011)
44. A.S. Tin, S.N. Sundar, K.Q. Tran, A.H. Park, K.M. Poindexter,G.L. Firestone, Anticancer Drugs23, 370–379 (2012)
45. C.Z. Zhang, H. Zhang, J. Yun, G.G. Chen, P.B. Lai, Biochem.Pharmacol.83, 1278–1289 (2012)
46. J.L. Zhang, Z. Wang, W. Hu, S.S. Chen, X.E. Lou, H.J. Zhou,Microvasc. Res.87, 14–24 (2013)
47. H. Sun, X. Meng, J. Han, Z. Zhang, B. Wang, X. Bai, X. Zhang,Tumour Biol.34, 3791–3800 (2013)
48. N.P. Singh, K.B. Verma, Arch. Oncol.10, 279–280 (2002)
49. T.G. Berger, D. Dieckmann, T. Efferth, E.S. Schultz, J.O. Funk,A. Baur, G. Schuler, Oncol. Rep.14, 1599–1603 (2005)
50. G.R. Rutteman, S.A. Erich, J.A. Mol, B. Spee, G.C. Grinwis, L.Fleckenstein, C.A. London, T. Efferth, Anticancer Res.33,1819–1827 (2013)
51. Jansen FH, Adoubi I, J C KC, DE Cnodder T, Jansen N, Tsch-ulakow A, Efferth T. Anticancer Res.2011,31, 4417–4422
52. M.A. Atemnkeng, B. Chimanuka, B. Dejaegher, Y.V. Heyden, J.Plaizier-Vercammen, Exp. Parasitol.122, 344–348 (2009)
53. M.U. Eteng, A.O. Abolaji, P.E. Ebong, E.A. Brisibe, A. Dar, N.Kabir, M. Iqbal Choudhary, Phytother. Res.27, 602–609 (2013)
54. M.S. Müller, N. Runyambo, I. Wagner, S. Borrmann, K. Dietz, L.Heide, Trans. R. Soc. Trop. Med. Hyg.98, 318–321 (2004)
55. RITAM Artemisia annua Task Force, M. Willcox, J. Falquet, J.F.Ferreira, B. Gilbert, E. Hsu, P.M. de Magalha ̃es, J. Plaizier-Vercammen, V.P. Sharma, C.W. Wright, W. Yaode, Afr. J. Tra-dit. Complement. Altern. Med.4, 121–123 (2006)
56. C.H. Blanke, G.B. Naisabha, M.B. Balema, G.M. Mbaruku, L.Heide, M.S. Mu ̈ller, Trop. Doctor38, 113–116 (2008)
57. P. Rasoanaivo, C.W. Wright, M.L. Willcox, B. Gilbert, Malaria J.10(Suppl 1), S4 (2011)
58. F. van der Kooy, S.E. Sullivan, J. Ethnopharmacol.150, 1–13(2013)
59. M.S. Mu ̈ller, I.B. Karhagomba, H.M. Hirt, E. Wemakor, J. Eth-nopharmacol.73, 487–493 (2000)
60. S. de Ridder, F. van der Kooy, R. Verpoorte, J. Ethnopharmacol.120, 302–314 (2008)
61. T. Efferth, F. Herrmann, A. Tahrani, M. Wink, Phytomedicine18, 959–969 (2011)
62. N.P. Singh, J.F. Ferreira, J.S. Park, H.C. Lai, Planta Med.77,1788–1793 (2011)
63. E.G. MacEwen, Cancer Metast. Rev.9, 125–136 (1990)
64. Chinese Pharmacopeia Commission,Pharmacopoeia of the People’s Republic of China 2010(Deutscher Apotheker Verlag,Stuttgart, 2011)
65. C. Righeschi, T. Eichhorn, A. Karioti, A.R. Bilia, T. Efferth,Cancer Genomics Proteomics9, 143–151 (2012)
66. B.A. Teicher, Mol. Cancer Ther.5, 2435–2443 (2006)
67. G.L. Disbrow, A.C. Baege, K.A. Kierpiec, H. Yuan, J.A. Cent-eno, C.A. Thibodeaux, D. Hartmann, R. Schlegel, Cancer Res.65, 10854–10861 (2005)
68. S.A. Frazier, S.M. Johns, J. Ortega, A.L. Zwingenberger, M.S.Kent, G.M. Hammond, C.O. Rodriguez Jr, M.A. Steffey, K.A.Skorupski, Vet. Comp. Oncol.10, 33–43 (2012)
69. W.M. Adams, P.E. Miller, D.M. Vail, L.J. Forrest, E.G. MacE-wen, Vet. Radiol. Ultrasound.39, 475–481 (1998)
70. A.P. Theon, B.R. Madewell, M.F. Harb, D.L. Dungworth, J. Am.Vet. Med. Assoc.202, 1469–1475 (1993)
71. W.M. Adams, S.J. Withrow, R. Walshaw, J.M. Turrell, S.M.Evans, M.A. Walker, I.D. Kurzman, J. Am. Vet. Med. Assoc.191, 311–315 (1987)
72. M.E. Nadeau, B.E. Kitchell, R.L. Rooks, S.M. LaRue, Vet.Radiol. Ultrasound.45, 362–367 (2004)
73. W.M. Adams, D.E. Bjorling, J.E. McAnulty, E.M. Green, L.J.Forrest, D.M. Vail, J. Am. Vet. Med. Assoc.227, 936–941 (2005)
74. S.E. Lana, W.S. Dernell, M.H. Lafferty, S.J. Withrow, S.M.LaRue, Vet. Radiol. Ultrasound.45, 577–581 (2004)
75. V. Langova, A.J. Mutsaers, B. Phillips, R. Straw, Aust. Vet. J.82,676–680 (2004)
76. Y.Y. Tu, M.Y. Ni, Y.R. Zhong, L.N. Li, S.L. Cui, M.Q. Zhang,X.Z. Wang, Z. Ji, X.T. Liang, Planta Med.44, 143–145 (1982)
77. J. Han, M. Ye, X. Qiao, M. Xu, B.R. Wang, D.A. Guo, J. Pharm.Biomed. Anal.47, 516–525 (2008)
78. T. Carbonara, R. Pascale, M.P. Argentieri, P. Papadia, F.P.Fanizzi, L. Villanova, P. Avato, J. Pharm. Biomed. Anal.62,79–86 (2012)
79. N.S. Radulovic ́, P.J. Randjelovic ́, N.M. Stojanovic ́, P.D. Blag-ojevic ́, Z.Z. Stojanovic ́-Radic ́, I.R. Ilic ́, V.B. Djordjevic ́, FoodChem. Toxicol.58, 37–49 (2013)
80. X.L. Liu, L. Zhang, X.L. Fu, K. Chen, B.C. Qian, Acta Phar-macol. Sin.22, 929–933 (2001)
81. M. Adams, T. Efferth, R. Bauer, Planta Med.72, 862–864 (2006)
82. X. Cai, J. Yang, J. Zhou, W. Lu, C. Hu, Z. Gu, J. Huo, X. Wang,P. Cao, Bioorg. Med. Chem.21, 84–92 (2013)
