Retrospektive Untersuchung von Tumoren kleiner Haustiere, die mit Artemisia annua und Eisen behandelt wurden
MOHAMED E.M. SAEED 1*, ELMAR BREUER 2*, MOHAMED‑ELAMIR F. HEGAZY 1 und THOMAS EFFERTH 1
1 Department of Pharmaceutical Biology, Institute of Pharmacy and Biochemistry, Johannes Gutenberg University, Mainz, D‑55128 Rhineland‑Palatinate;
2 Veterinary Clinic for Small Animals, ‘Alte Ziegelei’ Müllheim, D‑79379 Baden, Germany
Eingegangen am 26. Februar 2019; Akzeptiert am 7. Oktober 2019
Abstrakt.
Artemisinin aus Artemisia annua L. und seine Derivate sind bekannte Malariamedikamente. Darüber hinaus haben In-vitro-Studien, In-vivo-Studien und klinische Studien gezeigt, dass diese Arzneimittel bei menschlichen Krebspatienten eine Antikrebsaktivität aufweisen. Ziel der vorliegenden Studie war es daher zu untersuchen, ob ein phytotherapeutisches A. annua-Präparat bei Tumoren kleiner Haustiere eine Antikrebsaktivität ausübt. Hunde und Katzen mit spontanem Krebs (n = 20) wurden mit einer Standardtherapie plus einem kommerziellen A. annua-Präparat (LupArte®) behandelt und mit einer Kontrollgruppe verglichen, die nur mit einer Standardtherapie behandelt wurde (n = 11). Immunhistochemische Analysen wurden mit formalinfixierten, in Paraffin eingebetteten Tumorbiopsien durchgeführt, um die Expression des Transferrinrezeptors (TfR) und des Proliferationsmarkers Ki-67 als mögliche Biomarker zur Beurteilung des Behandlungsansprechens von Tumoren auf A. annua zu analysieren. Schließlich wurden die Expressionsniveaus von TfR und Ki-67 mit den IC50-Werten gegenüber Artemisinin in zwei Hundetumorzelllinien (DH82 und DGBM) und einer Gruppe von 54 menschlichen Tumorzelllinien verglichen. Retrospektiv bewertete die vorliegende Studie die Überlebenszeiten von Kleintieren, die mit Standardtherapie mit oder ohne A. annua behandelt wurden. Die A. annua-Behandlung war mit einer signifikant höheren Anzahl von Tieren verbunden, die > 18 Monate überlebten, verglichen mit Tieren ohne A. annua-Behandlung (P = 0,0331). Unter Verwendung eines zweiten Satzes kleiner Haustiertumoren wurde durch Immunhistochemie eine signifikante Korrelation zwischen TfR- und Ki-67-Expression identifiziert (P = 0,025). Um die Assoziation der Transferrin- und Ki-67-Expression mit der zellulären Reaktion auf Artemisinin weiter zu untersuchen, wurden in der vorliegenden Studie die Expression dieser beiden Biomarker und die IC50-Werte für Artemisinin in Tumorzelllinien des National Cancer Institute in vitro verglichen. Beide Marker waren umgekehrt mit der Artemisinin-Reaktion assoziiert (P <0,05), und die Expressionsniveaus von TfR und Ki-67 waren signifikant korreliert (P = 0,008). Zusammenfassend lässt sich sagen, dass die vielversprechenden Ergebnisse der vorliegenden retrospektiven Studie eine weitere Bestätigung durch prospektive Studien in der Zukunft rechtfertigen.
Einleitung
Labortiere sind für die biomedizinische Forschung unverzichtbar. Sie werden verwendet, um Krankheitsmodelle zu entwickeln, um die Pathogenese menschlicher Krankheiten besser zu verstehen und um neue Behandlungsoptionen zu entwickeln. In der Krebsforschung werden seit Jahrzehnten transplantierte syngene, xenotransplantierte und orthotope Tumormodelle oder chemisch induzierte Tumoren bei Mäusen oder Ratten verwendet (1). Trotz dieser weit verbreiteten Tierversuchsmodelle wurde in der menschlichen Onkologie übersehen, dass Tiere in vergleichbarer Weise wie menschliche Patienten an spontan auftretenden Tumoren leiden können. Diese Tiertumore sind im Vergleich zu experimentellen Tumormodellen sehr eng mit der Situation beim Menschen verbunden, da sie spontan auftreten und weder durch Transplantation aufrechterhalten noch durch chemische Karzinogene induziert werden (2). Spontane Tumore bei Tieren bieten daher eine attraktive, wenn auch unterschätzte Möglichkeit, neuartige Behandlungsstrategien vor der klinischen Anwendung bei Krebspatienten zu untersuchen. Da die Behandlung von spontanen Tumoren bei Tieren auch in der Veterinärmedizin von Bedeutung ist, sind Studien zu Tumoren bei Tieren auch für die veterinärmedizinische Onkologie von großer Bedeutung. Die Überlebensprognose von bösartigen Tumoren bei Kleintieren ist bei weitem nicht zufriedenstellend und die Mehrheit erliegt der Krankheit auch nach Anwendung chirurgischer, radioaktiver oder chemotherapeutischer Eingriffe (3,4). Die klinische Prognose sowie klinische, pathologische und biochemische Faktoren, die das Überleben von Haustieren beeinflussen, wurden für Hunde (5-9, 13), Katzen (10-12) und andere Arten (14,15) angegeben. Trotz erheblicher Fortschritte bei der Behandlung von veterinärmedizinischen und menschlichen Tumoren bleibt die Situation schlecht und zahlreiche Patienten erliegen ihrer Krankheit. Daher sind neuartige Behandlungsmöglichkeiten dringend erforderlich.
Die Mehrzahl der klinisch etablierten Arzneimittel stammt aus Naturstoffen (16). Daher scheint die Suche nach neuartigen Behandlungen bei Verwendung natürlicher Quellen am vielversprechendsten zu sein. Ein aktuelles Beispiel für die Gültigkeit dieses Konzepts ist Artemisinin. Artemisinin ist ein bioaktives Terpenoid, das aus Artemisia annua L. isoliert wurde, einem Heilkraut, das seit etwa zwei Jahrtausenden in der traditionellen chinesischen Medizin verwendet wird (17). Die Isolierung von Artemisinin aus A. führte zu einer neuartigen Behandlungsoption von herausragender Bedeutung für Malaria. Artemisinin und seine Derivate sind für das Überleben von Millionen von Malariapatienten verantwortlich (18, 19). Diese Leistung wurde 2015 mit der Verleihung des Nobelpreises für Medizin oder Physiologie an den chinesischen Wissenschaftler Youyou Tu (20) gewürdigt. Während Artemisinin-Derivate wie Artemether und Artesunat als Malariamedikamente gut etabliert sind, hemmen pflanzliche Präparate von A. annua auch Plasmodia-Infektionen bei Patienten mit Malaria (21). Insbesondere ist die Bioaktivität von Artemisinin nicht auf Malaria beschränkt, und andere Krankheiten sind auch anfällig für die Behandlung mit Artemisinin und A. annua, wie Bilharziose und Trypan-Somiasis (22-24), verschiedene Virusinfektionen (25) und Krankheiten im Zusammenhang mit metabolischen Syndromen, einschließlich Fettleibigkeit, Diabetes und Atherosklerose (26-28).
Artemisinin-Derivate hemmen auch das Wachstum menschlicher Tumorzellen in vitro und in vivo (29-31). Dies ist nicht nur für die Krebstherapie relevant, sondern auch für die Krebsprävention (32, 33). Artemisinin-Derivate üben additive oder synergistische Wechselwirkungen in Kombination mit einer Vielzahl klinisch etablierter Arzneimittel aus (34-36). Dies wurde auch in veterinärmedizinischen Tumorzelllinien in vitro und in veterinärmedizinischen klinischen Studien nachgewiesen (37-39). Basierend auf der Antikrebsaktivität in experimentellen Tumormodellen war es möglich, die Antikrebsaktivität bei Härtefällen menschlicher Krebspatienten zu untersuchen (40, 41) und sogar klinische Phase I/II Studien bei menschlichen Krebspatienten durchzuführen (42) ‑44). Eine andere frühere klinische Phase I/II Studie zeigte die Antikrebsaktivität bei einer Reihe von Hunden mit Tumoren (39). Vorläufige Ergebnisse bei drei Hunden und einer Katze zeigten, dass ein Kräuterpräparat von A. annua (LupArte®) möglicherweise die Überlebenszeit von Tieren mit Tumoren verlängert (45). Um diese vorläufigen Ergebnisse von A. annua bei Härtefällen zu untermauern, hat die vorliegende Studie eine retrospektive Analyse durchgeführt, indem die Überlebenszeiten von 25 mit A. annua behandelten Haustieren im Vergleich zu 11 Tieren ohne A. annua-Behandlung bewertet wurden. Unabhängig von der Nahrungsergänzung mit A. annua wurden alle Tiere Standardbehandlungsprotokollen unterzogen. Zusätzlich wurde die Expression von zwei Biomarkern, dem Transferrinrezeptor (TfR) und dem Proliferationsmarker Ki-67, durch immunhistochemische Analyse von Tumorbiopsien bestimmt.
Materialien und Methoden
Artemisininbestimmung in A. annua. Kernspinresonanzspektren (NMR) wurden mit einem Bruker 300-NMR-Spektrometer (Bruker Corporation) aufgenommen. Umkehrphasen-Hochleistungsflüssigkeitschromatographie-(HPLC-)Massenspektrometrie (MS)-Analyse wurde an einer Waters Alliance 2695 LC (Waters Corporation) durchgeführt, die an eine Quattro Ultima-Dreifach-Quadrupol-MS (Waters Corporation) gekoppelt war, und zwar unter Verwendung der gleichen Trennbedingungen wie zuvor beschrieben
( 46). Die Trennbedingungen waren wie folgt: Chromatogrammsäule, XBridge™-Säule (4,6 × 150 mm, 5 µm); Säulentemperatur 20 ° C; und Injektionsvolumen 1 µl. Die Elution wurde mit einer Fließgeschwindigkeit von 1 ml / min durchgeführt, wobei als mobile Phase ein Gemisch aus Wasser (A) und Acetonitril (B) verwendet wurde. Die Proben wurden unter Verwendung des folgenden Gradienten eluiert: 0 min, 98,0% A; 0–8 min, linearer Anstieg auf 100% B; 100% A für 2 min, 11-12 min gehalten, Rückkehr auf 98,0% A. Die endgültige Optimierung der Betriebsparameter der ESI-Quelle war ein Stickstoffgasstrom von 11 l / min, ein Zerstäuber von 30 psi, eine Kapillarspannung von ± 2,4 kV und eine Trocknungsgastemperatur von 250 ° C (N2). Die Quattro Ultima Triple Quadrupol MS arbeitete im Mehrfachreaktionsüberwachungsmodus mit einer Auflösung von 0,7 m / z. Elektrospray-Ionisation (positiver Modus) und Photodiodenarray-Detektion bei 254 nm wurden durchgeführt. Verschiedene Chargen von A. annua (LupArte®) wurden vom Institut für Pharmazeutische Biologie der Universität Johannes Gutenberg (Mainz, Deutschland) bestimmt. Dieser verblindete Ansatz wurde als Qualitätsmaß verwendet, um das Vorhandensein von Artemisinin in LupArte® unabhängig zu gewährleisten. Jede Charge von A. annua-Pulver (2 × 10 g) wurde mit zwei Lösungsmitteln unterschiedlicher Polarität, Methylenchlorid und Methanol, 24 h bei Raumtemperatur extrahiert. Der Extrakt wurde im Vakuum eingeengt, wobei ein Rückstand von 0,8 und 1,2 g für Methylenchlorid bzw. Methanol erhalten wurde. Jeder Extrakt wurde in ein kleines Fläschchen überführt und bei Raumtemperatur trocken gehalten. Es bildeten sich kleine Kristalle, die gesammelt und mit n-Hexan und Methylenchlorid gewaschen wurden, um Extraktreste zu entfernen. Dann wurden 1H- und 13C-NMR-Analysen durchgeführt.
Tumore
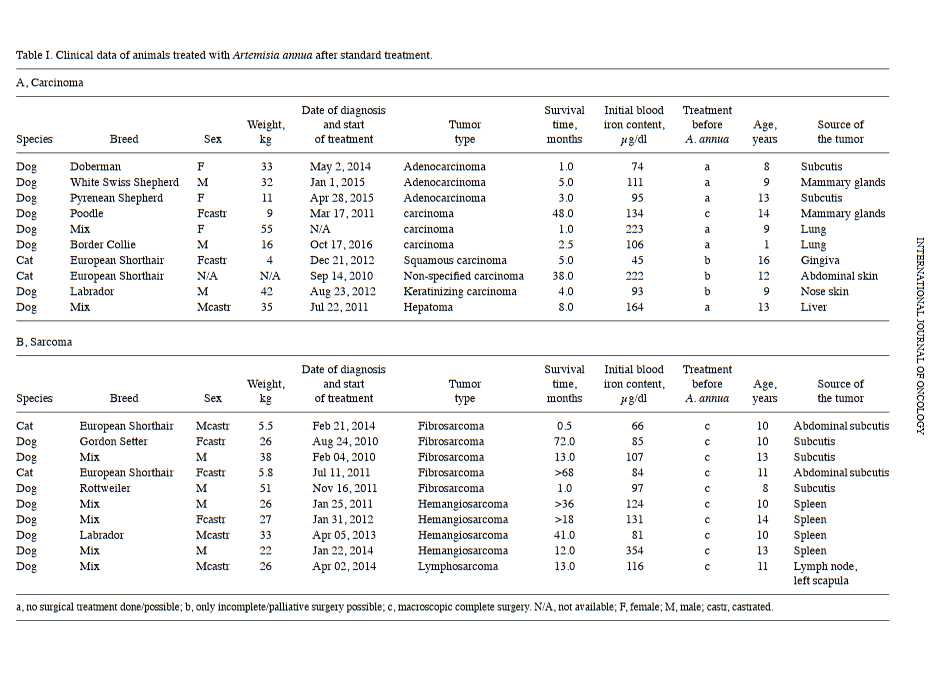
Die Tiere wurden zwischen 2010 und 2017 behandelt. Kurz gesagt wurden 16 Hunde (10 Rüden und 6 Weibchen) und 4 Katzen (2 weiblich, 1 männlich und 1 N / A) mit A. annua behandelt. Das Durchschnittsalter der Hunde betrug 10,31 Jahre und das Durchschnittsalter der Katzen 12,25 Jahre. Das Durchschnittsgewicht der Hunde betrug 30,125 kg und das Durchschnittsgewicht der Katzen 5,10 kg. Von allen Tieren wurden Gewebeproben entnommen und zunächst 48 h bei Raumtemperatur (~ 22 ° C) in 4%-iger Formaldehydlösung fixiert. Nach der Fixierung wurden die Organe zugeschnitten, verarbeitet und bei etwa 60 ° C in Paraffinwachs eingebettet. Die Schnitte wurden auf eine Dicke von 4 µm geschnitten und routinemäßig bei Raumtemperatur mit Hämatoxylin und Eosin gefärbt. Die histopathologische Untersuchung der mit Hämatoxylin und Eosin gefärbten Schnitte wurde unter einem Lichtmikroskop in Immersionsöl mit einem Zeiss Axioskop durchgeführt. Nach routinemäßiger pathologischer Diagnose wurden die Paraffinblöcke als überschüssiges Material für nachfolgende immunhistochemische Untersuchungen verwendet. Darüber hinaus wurden die mit histologischem Hämatoxylin und Eosin gefärbten Tumorschnitte auf das Vorhandensein von Tumor-infiltrierenden Lymphozyten (TILs) untersucht. Die klinischen Daten sind in den Tabellen I und II dargestellt. Die Besitzer der Tiere gaben eine schriftliche Einverständniserklärung für diese retrospektive Studie ab. Die unterschriebenen schriftlichen Einverständniserklärungen sind am Institut für Pharmazeutische Biologie der Johannes Gutenberg-Universität (Mainz) hinterlegt und können auf Anfrage eingesehen werden.
Behandlungsprotokoll
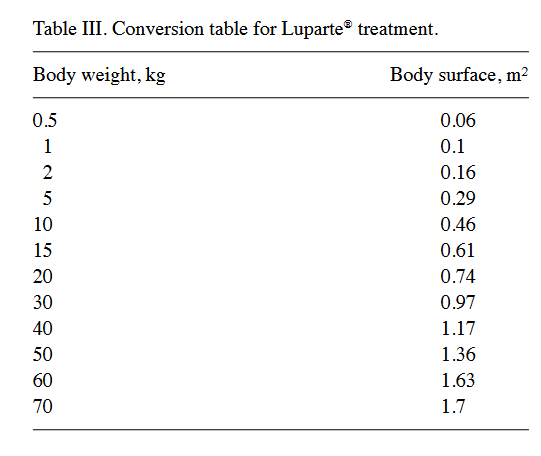
Der Serumeisengehalt wurde nach Entnahme von Blutproben bestimmt; Ein normaler Bereich liegt zwischen 140 und 170 μg / dl (47). Nach anfänglicher Bestimmung des Eisengehalts unter Verwendung des Ferrozin-Farbtests (48) wurden die Tumore nach visueller Inspektion und gegebenenfalls nach Lungenradiographie nach einem Standardprotokoll chirurgisch mit Sicherheitsrändern entfernt. Zwischen der Blutentnahme und der Bestimmung des Serumeisens aus dem klinischen Diagnoselabor wurde Eisen oral verabreicht [Ferrosanol®-Kapseln (100 mg / Kapsel oder 40 mg / Kapsel)]. Die Dosierung betrug 100 mg / 30 kg Körpergewicht zweimal täglich, gemischt mit pflanzenarmen Lebensmitteln, um eisenbindende Pflanzenmoleküle wie Phytan, Oxalate und / oder Phosphate zu vermeiden. Alternativ wurde Eisen subkutan (Myofer® / Ursoferran®; 100 mg / ml) in einer Dosis von 100 mg / 10 kg Körpergewicht täglich injiziert, bis die Serum-Eisen-Ergebnisse vom klinischen Labor zurückerhalten wurden. Die Eisensubstitution wurde einzeln fortgesetzt, bis ein Eisengehalt von 250 ± 30 & μg / dl (~ 43 ± 5 μmol / l) im Blutserum stabil erreicht war. Ab dem vierten Tag der anfänglichen Eisensubstitution wurden die Tiere oral mit LupArte®-Kapseln in einer Dosierung von 1.400 mg / m2 Körperoberfläche behandelt, aufgeteilt auf drei Gaben pro Tag (Tabelle III). Die Kapseln wurden 1 bis 2 Stunden vor der nächsten Mahlzeit verabreicht. Der Serumeisengehalt wurde regelmäßig überwacht und erforderlichenfalls an 250 ± 30 μg / dl angepasst. Die Behandlungsdetails und die Follow-up-Informationen, einschließlich der Überlebenszeiten, wurden in den Akten der klinischen Dokumentation aufgezeichnet. Alle ethischen Fragen wurden vor der Auswertung klinischer und experimenteller Daten mit dem Regierungspräsidium Freiburg (Deutschland) erörtert. Nach dem Entwurf dieser retrospektiven Studie erteilte das Regierungspräsidium Freiburg eine schriftliche Genehmigung für die vorliegende Studie (Az. 35-9185.81 / 1 vom 4. Februar 2019).
Zelllinien
Die D-GBM-Zelllinie wurde von Dr. George Stoica (Abteilung für Veterinärpathobiologie, Texas A & M University, College Station, TX, USA) aus einem Hirntumor eines 8 Jahre alten männlichen Boxerhundes (49) erzeugt. Die in der vorliegenden Studie verwendeten D-GBM-Zellen wurden von Dr. Pablo Steinberg (Institut für Lebensmitteltoxikologie und Analytische Chemie, Veterinärmedizinische Universität Hannover, Hannover, Deutschland) erhalten, der sie von Dr. G. Stoica erhielt. Die histiozytische DH82-Zelllinie wurde von Dr. ML Wellman (Abteilung für Veterinärpathobiologie, College für Veterinärmedizin, Ohio State University, CO, USA) generiert (50). Die in der vorliegenden Studie verwendete DH82-Zelllinie wurde auch von Dr. Pablo Steinberg erhalten, der sie von der European Tissue Culture Collection (Katalog Nr. 94062922) erwarb. Ein Panel von 54 menschlichen Tumorzelllinien des Developmental Therapeutics Program (DTP) des National Cancer Institute bestand aus Zelllinien, die aus Leukämie, Melanom, nichtkleinzelligem Lungenkrebs, Dickdarmkrebs, Nierenkrebs, Eierstockkrebs, Brustkrebs und Prostatakarzinom sowie Tumoren des Zentralnervensystems stammten (51). Zuvor wurde die Zytotoxizität von Zellen, die 48 Stunden lang mit Artemisinin behandelt wurden, mit einem Sulforhodamin-B-Assay bewertet (52). Die log10 IC50-Werte für Artemisinin- und mRNA-Expressionen für Ki-67 und TfR waren öffentlich in der DTP-Datenbank (https://dtp.cancer.gov/default.htm) verfügbar.
Zytotoxizitätstest.
Ein Resazurin-Reduktionsassay (Promega Corporation) wurde wie zuvor beschrieben durchgeführt (53), um die Zytotoxizität von Artemisinin, Artesunat und Dihydro-Artemisinin gegenüber den Hundetumorzelllinien DH82 und DGBM zu bewerten. Das Konzept des Assays basiert auf der metabolischen Reduktion des nicht fluoreszierenden Farbstoffs durch lebende Zellen zu dem stark fluoreszierenden Farbstoff Resorufin (54). Die IC50-Werte wurden aus Dosis-Wirkungs-Kurven unter Verwendung eines nichtlinearen Regressionsanalysetools in der GraphPad Prism 7-Software (GraphPad Prism, Inc.) berechnet. Alle IC50-Werte werden als Mittelwert ± Standardabweichung ausgedrückt. Jeder Assay wurde dreimal unabhängig mit jeweils sechs Wiederholungen durchgeführt.
Immunhistochemie
Insgesamt 17 Tumorgewebe, die verschiedene Tumortypen bei Haustieren repräsentieren, wurden gesammelt, um die Expression von Ki-67 und TfR in Tiertumoren zu bewerten (Tabelle V). Kurz gesagt wurden Tumorgewebe von 15 Hunden (7 Rüden und 8 Weibchen) und 2 Katzen (beide weiblich) erhalten. Das Durchschnittsalter der Hunde betrug 9,33 Jahre und das Durchschnittsalter der Katzen 4 Jahre. Das Durchschnittsgewicht der Hunde betrug 27,266 kg und das Durchschnittsgewicht der Katzen 4,00 kg. Alle ausgewählten Tiere wurden unter Tierhaltungsbedingungen gehalten. Die immunhistochemische Färbung von Tumorgeweben wurde wie zuvor beschrieben durchgeführt (55). Die Objektträger wurden zweimal mit Xylol (98,5% Xylol jeweils 5 min bei Raumtemperatur) gewaschen, um Paraffin zu entfernen. Dann wurden die Probengewebe durch abgestufte Waschungen mit Isopropanol in Wasser rehydratisiert. Die hitzeinduzierte Epitopgewinnung wurde unter Verwendung eines Schnellkochtopfs als Heizvorrichtung durchgeführt. Ein Ultra-Vision-Proteinblock und UltraVision-Wasserstoffperoxidblock (Katalognummern TA-060-UB bzw. TA-060-H2O2Q; Thermo Fisher Scientific, Inc.) wurden hinzugefügt, um endogene Proteine bzw. endogene Peroxidaseaktivität zu blockieren und eine unspezifische Hintergrundfärbung zu vermeiden. Die Inkubation über Nacht bei 4°C wurde nach Zugabe von monoklonalen Primärantikörpern durchgeführt. Zum Nachweis von Ki-67 wurde der SP6-Klon (Katalognummer ab16667; Abcam) in einer Verdünnung von 1: 200 verwendet. Zur Bestimmung der TfR-Expression wurde der H68.4-Klon (Katalog Nr. 136800; Thermo Fisher Scientific, Inc.) in einer Verdünnung von 1: 100 angewendet. Anschließend wurden Meerrettichperoxidase-markierte Polymere, die mit Sekundärantikörpern konjugiert waren, die sowohl für Maus- als auch für Kaninchen-Primärantikörper spezifisch sind, bei Raumtemperatur für 1 h nach Protokoll des Herstellers zugegeben (Katalognummern TL-060-QPH und TL-060-QPB; Thermo Fisher Scientific, Inc.). Die endgültige Färbereaktion wurde mit Diaminobenzidin durchgeführt und die Objektträger wurden 3 Minuten lang bei Raumtemperatur mit Hämatoxylin gegengefärbt.
Die Immunfärbung von DH82- und DGBM-Zelllinien wurde ohne die Rehydratisierungs- oder Epitop-Wiedergewinnungsschritte durchgeführt. Kurz gesagt wurden sechs Deckgläser in eine 6-Well-Platte gegeben, dann wurden 5 × 105 Zellen / Well über die Deckgläser ausgesät und über Nacht bei 37 ° C in einer angefeuchteten 5% CO2 -Atmosphäre inkubiert, damit sich die Zellen an den Deckgläsern festsetzen konnten. Anschließend wurden die Zellen 15 min bei Raumtemperatur in 4% Paraformaldehyd fixiert und die Blockierungs- und Färbeschritte wie für den Gewebeschnitt beschrieben durchgeführt. Die Ki-67- und TfR-Antikörper wurden jedoch mit 1: 500 bzw. 1: 1000 verdünnt. Die immungefärbten Objektträger wurden unter Verwendung von Pannoramic Desk (3DHISTECH Ltd.) gescannt und die Menge an Ki-67- oder TfR-exprimierenden Zellen wurde mit der Pannoramic Viewer-Software Version 1.15 (3DHISTECH Ltd.) quantifiziert.
Statistische Analyse. Signifikanzwerte und Korrelationskoeffizienten wurden unter Verwendung des Pearson-Korrelationskoeffizienten und des exakten Fisher-Tests mit dem WinSTAT-Softwareprogramm Version 2012.1 (www.winstat.com/) berechnet. Die lineare Regression wurde unter Verwendung von Excel 2016 (Microsoft Corporation) für die log10 IC50-Werte für Artemisinin- und mRNA-Expressionen für Ki-67 und TfR durchgeführt. P <0,05 wurde als Hinweis auf einen statistisch signifikanten Unterschied angesehen.
Ergebnisse
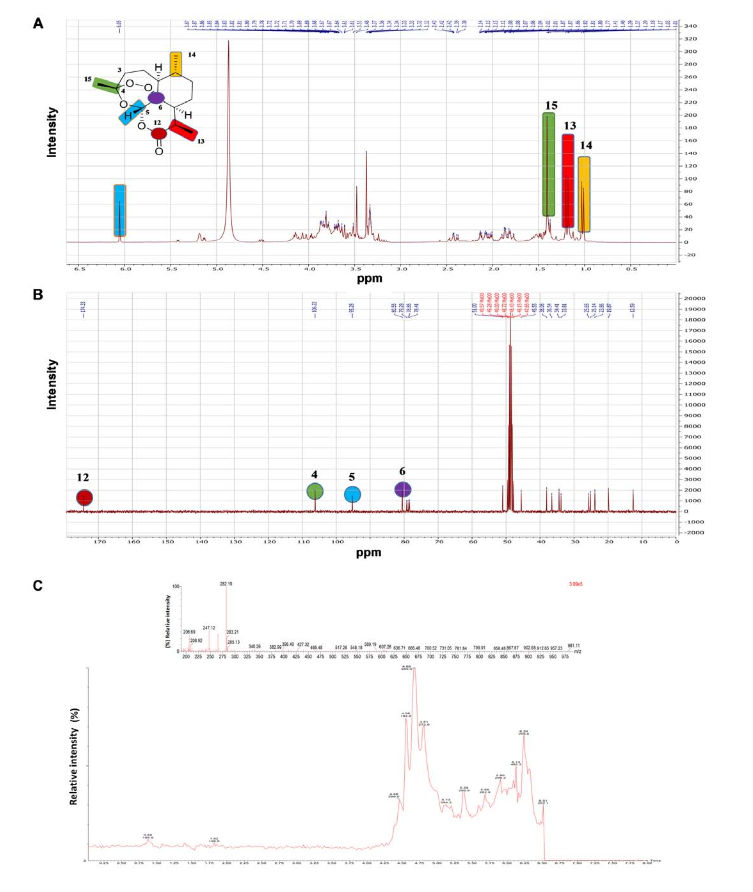
Identifizierung von Artemisinin. Wie in Abb. 1A dargestellt, enthielt das 1H-NMR-Spektrum eines farblosen Kristalls für Artemisinin typische Signale. Das Spektrum zeigte Signale für drei Methylgruppen: Zwei sekundäre bei δh 1,00 (d, J = 6,5, H-14), 1,17 (d, J = 7,2, H-13) und ein tertiäres Methylsignal bei δH 1,40 (s), H-15). Zusätzlich wurden zwei aliphatische Methylen-Signale bei δH 2,12 (brddd, J = 14,9,4,2,2,6) und 2,40 (ddd, J = 14,9, 13,1,4,1) für H-3a bzw. H-3b beobachtet. Ein charakteristisches Downfield-Singulettsignal bei δH 6.01 zeigte das Vorhandensein eines sauerstoffhaltigen Protons für H-5 an. Wie in 1B dargestellt, zeigte das 13C-NMR-Spektrum 15 Hauptkohlenstoffsignale, einschließlich signifikanter Kohlenstoffsignale, die das Vorhandensein von Artemisinin wie folgt bestätigen: δC 173,3 (s, C-12), 105,2 (s, C-4), 94,3 (d, C-5) und 79,5 (s, C-6) (56). Umkehrphasen-HPLC-MS wurde verwendet, um das Vorhandensein von Artemisinin quantitativ zu analysieren. Abb. 1C zeigt das nach Auflösung von 2 mg / ml MeOH-Extrakt erhaltene Chromatogramm, das darauf hinweist, dass Artemisinin 3,46% des A. annua (LupArte®) -Extrakts ausmacht.
Abbildung 1. NMR-Spektren von A. annua-Chloroformextrakt, die das Vorhandensein von Artemisinin zeigen.(A) 1 H-NMR (300 MHz). (B) 13 C-NMR (75 MHz). (C) RP-HPLC / MS-Chromatogramm von A. annua (Luparte®) -Extrakt. Die obere Abbildung zeigt das MS-Profil, während die untere Abbildung die HPLC-Messungen darstellt. NMR, Kernspinresonanz; RP-HPLC / MS, Umkehrphasen-Hochleistungsflüssigchromatographie-Massenspektrometrie.
Abbildung 2. Hämatoxylin- und Eosin-Färbung verschiedener Haustiertumore. (A) Tubulopapilläres Brustadenokarzinom. (B) Weichteilsarkom. (C) Plattenepithelkarzinom. (D) Neuroendokrines Karzinom. Vergrößerung x40.
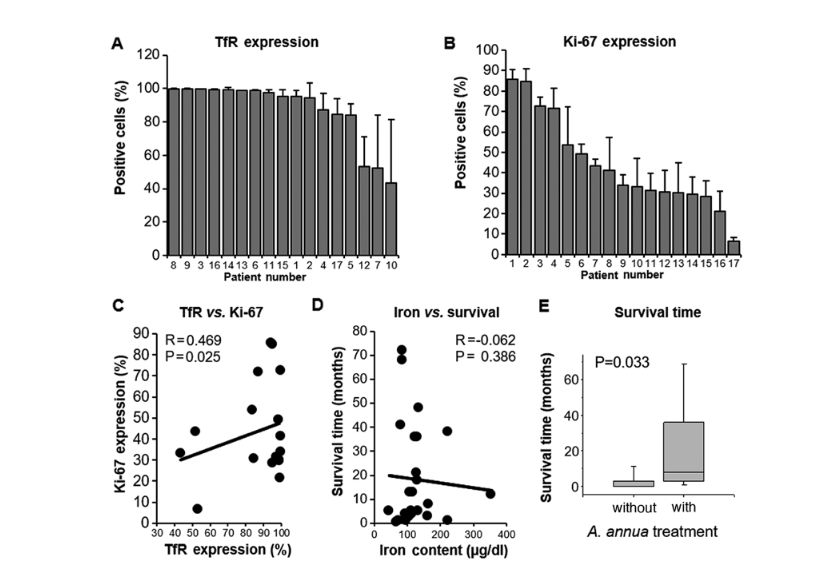 Abbildung 3. Quantifizierung der immunhistochemischen Färbung von Veterinärtumoren und Korrelation mit klinischen Parametern. (A) TfR-Expression. (B) Ki-67-Ausdruck. (C) Korrelation der TfR-Expression mit der Ki-67-Expression. (D) Korrelation des Bluteisengehalts mit der Überlebenszeit. (E) Überlebenszeit von behandelten und unbehandelten Tieren (P = 0,033). Regressionsanalysen wurden mit Excel (Microsoft Corporation) durchgeführt. TfR, Transferrinrezeptor
Abbildung 3. Quantifizierung der immunhistochemischen Färbung von Veterinärtumoren und Korrelation mit klinischen Parametern. (A) TfR-Expression. (B) Ki-67-Ausdruck. (C) Korrelation der TfR-Expression mit der Ki-67-Expression. (D) Korrelation des Bluteisengehalts mit der Überlebenszeit. (E) Überlebenszeit von behandelten und unbehandelten Tieren (P = 0,033). Regressionsanalysen wurden mit Excel (Microsoft Corporation) durchgeführt. TfR, Transferrinrezeptor
Klinische Behandlung
Insgesamt wurden 23 Hunde und 8 Katzen in die vorliegende Studie aufgenommen. Unter diesen wurden 20 zusätzlich zu ihrer Standardtherapie (Tabelle I) mit A. annua behandelt und 11 wurden allein einer Standardbehandlung unterzogen (Tabelle II). Die mit A. annua behandelte Gruppe wies 10 Karzinome (bei 8 Hunden, 2 Katzen) und 10 Sarkome (bei 8 Hunden, 2 Katzen) auf. Alle Tiere wurden zwischen 2010 und 2017 behandelt (Tabelle I). In der Gruppe der Tiere ohne A. annua-Behandlung hatten 5 Tiere ein Karzinom (3 Hunde, 2 Katzen) und 6 Tiere ein Sarkom (4 Hunde, 2 Katzen) (Tabelle II). Der Eisengehalt im Blut und die Überlebenszeiten aller Haustiere wurden aufgezeichnet. Die Wirkung der Behandlung mit A. annua auf die Gesamtüberlebenszeit wurde bewertet. Insgesamt zeigten 13 mit A. annua behandelte Tiere und 11 nicht behandelte Tiere eine Überlebenszeit von <18 Monaten nach der Therapie. Während 7 Tiere in der mit A. annua behandelten Gruppe eine Überlebenszeit von > 18 Monaten nach der Behandlung mit A. annua hatten, überlebten keine Tiere in der nicht behandelten Gruppe > 18 Monate. Dieser Unterschied in den Überlebenszeiten zwischen den Gruppen war statistisch signifikant (P = 0,033; genauer Fisher-Test; Tabelle IV).
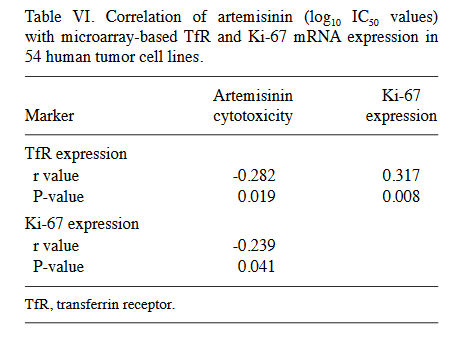
Histologie und Immunhistochemie. Unter Verwendung einer zweiten Sammlung von 17 Tumoren wurde die Histologie der Tumoren durch Hämatoxylin- und Eosin-Färbung von formalinfixierten und in Paraffin eingebetteten Tumorschnitten bestimmt. Repräsentative Fotografien verschiedener Tumorhistologien sind in 2 dargestellt, einschließlich eines tubulopapillären Brustadenokarzinoms, eines Weichteilsarkoms, eines Plattenepithelkarzinoms und eines neuroendokrinen Karzinoms. Darüber hinaus wurden immunhistochemische Analysen durchgeführt. Die membrangebundene Expression von TfR (CD71) und die nukleare Expression des Proliferationsmarkers Ki-67 wurden bestimmt. Der Prozentsatz der gefärbten Zellen wurde unter Verwendung eines computergestützten Quantifizierungssystems quantifiziert. Aus jedem Tumorabschnitt wurden sechs verschiedene Bereiche ausgewählt, um repräsentative Expressionswerte bereitzustellen. Der Prozentsatz der TfR-exprimierenden Zellen lag zwischen 43,5 (± 37,9%) und 99,2% (± 0,2%), während der Prozentsatz der Ki-67-positiven Zellen in einem Bereich zwischen 6,6 (± 1,8%) und 85,7% (± 4,7%) lag (Abb. 3A und B). Da die Tumorheterogenität eine wichtige Rolle bei der Reaktion auf die Krebstherapie spielt, konzentrierte sich die vorliegende Studie auch auf heterogene und homogene Färbungsmuster zwischen den verschiedenen Tumorbiopsien. Bestimmte Tumoren waren bei der immunhistochemischen Färbung sehr heterogen, während andere eine gleichmäßige Färbung zeigten. Dies zeigt sich in den Standardabweichungen, die zwischen 0,1 (Fälle Nr. 3, 8 und 13) und 37,9% (Fall 10) für TfR und zwischen 1,8 (Fall 17) und 16,3% (Fall 8) für Ki-67 lagen. (Tabelle V). Anschließend wurde die Korrelation zwischen der Expression von TfR und Ki-67 mit dem Satz von Tumorbiopsien untersucht, was eine statistisch signifikante Korrelation ergab (P = 0,025; r = 0,469; Abb. 3C). Es wurde keine signifikante Korrelation zwischen dem Eisengehalt im Blut und der Überlebenszeit der Tiere festgestellt (P = 0,386; r = –0,062; Abb. 3D). Bemerkenswerterweise war der Zusammenhang zwischen der Überlebenszeit und der Behandlung mit A. annua signifikant. Haustiere, die mit Standardtherapie plus A. annua behandelt wurden, hatten signifikant längere Überlebenszeiten als Haustiere, die nur mit Standardtherapie behandelt wurden (P = 0,033; Abb. 3E). Da der direkte Zusammenhang zwischen TfR- und Ki-67-Expression und der Zytotoxizität von Artemisinin in diesen Tumorproben nicht bewertet werden konnte, wurde die mRNA-Expression auf TfR- und Ki-67-Microarray-Basis in 54 menschlichen Tumorzelllinien im Vergleich zu den log10 IC50-Werten analysiert, die durch den Sulforhodamin-Assay bestimmt wurden. Sowohl die TfR- als auch die Ki-67-Expression korrelierten signifikant negativ mit der Zytotoxizität von Artemisinin in diesen Zelllinien (P <0,05; r <-0,20), was darauf hinweist, dass eine höhere Expression dieser beiden Marker mit einer höheren Empfindlichkeit der Zelllinien gegenüber Artemisinin verbunden war (Tabelle VI). Die Expressionsniveaus von TfR und Ki-67 waren positiv korreliert (P = 0,008; r = 0,317). Dieses Panel aus menschlichen Tumorlinien bestand aus Zelllinien, die von acht Tumorarten abgeleitet waren (Leukämie, Melanom und Hirntumor sowie Karzinom von Dickdarm, Brust, Eierstock, Niere und Prostata). Die Anzahl der Zelllinien jedes Tumortyps (n = 1–9) war zu gering, um signifikante Korrelationen mit Ausnahme der drei folgenden Ergebnisse aufzudecken. In Lungenkrebszelllinien korrelierten die log10 IC50-Werte von Artemisinin umgekehrt mit der Ki-67-Expression (P = 0,009; r = -0,759). In Melanomzelllinien waren die Expressionsniveaus von Ki-67 und TfR signifikant korreliert (P = 0,010; r = 0,787). In Nierenkrebszelllinien waren die Expressionsniveaus von Ki-67 und TfR ebenfalls signifikant korreliert (P = 0,019; r = 0,781) (Daten nicht gezeigt). Da alle anderen Assoziationen zwischen der Artemisinin-Reaktion und der Expression von Ki-67 und TfR statistisch nicht signifikant waren, können verlässliche Schlussfolgerungen zur Rolle von Ki-67 und TfR nur aus dem gesamten Zelllinienpanel gezogen werden, jedoch nicht aus dem Tumortyp.
Repräsentative Bilder der Immunfärbung für die TfR-Expression sind in Abb. 4A-D dargestellt. Eine starke TfR-Expression wurde in Biopsien von tubulopapillärem Brustadenokarzinom, Weichteilsarkom und Plattenepithelkarzinom festgestellt. Im Gegensatz dazu zeigte die Negativkontrolle keine Reaktivität, was auf die Spezifität des Immunfärbungsverfahrens hinweist. Darüber hinaus sind in Abb. 4E-H Beispiele für die Ki-67-Expression bei tubulopapillärem Brustadenokarzinom, Weichteilsarkom, Plattenepithel-karzinom und neuroendokrinen Karzinom dargestellt. Darüber hinaus ergab die Bewertung des Vorhandenseins von TILs in mit Hämatoxylin und Eosin gefärbten Tumorgeweben, dass in allen Tumorobjektträgern keine TILs vorhanden waren.
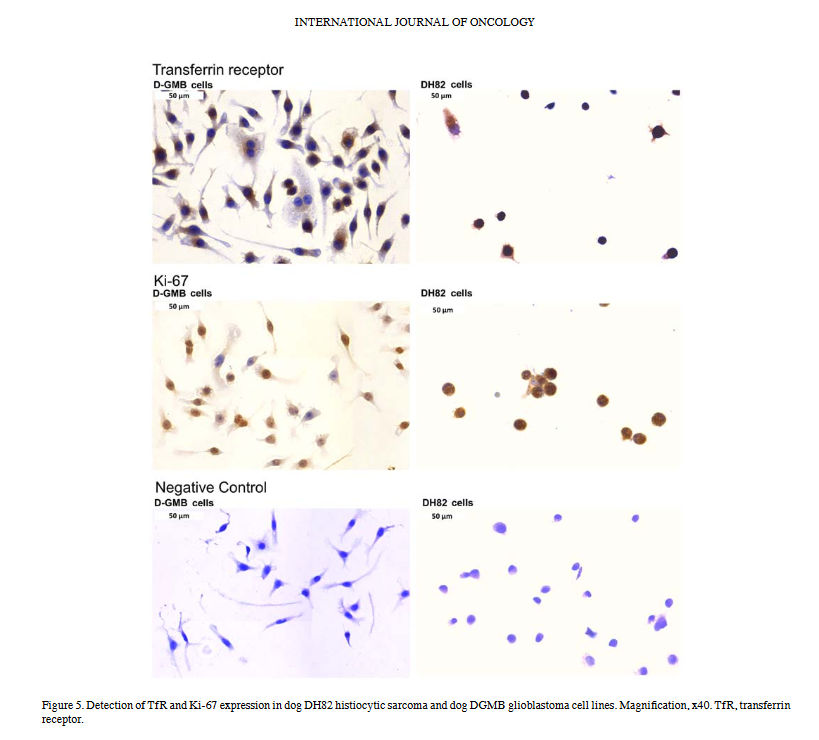
Zum Vergleich wurde die Ki-67- und TfR-Expression in zwei Hundezelllinien analysiert. Histiozytisches DH82-Sarkom und DGMB-Glioblastomzellen wurden für beide Marker immungefärbt. In der Tat wurden Ki-67 und TfR in beiden Zelllinien überexprimiert, wie in Abb. 5 dargestellt. Darüber hinaus untersuchte die vorliegende Studie die Zytotoxizität von Artemisinin, Artesunat und Dihydroartemis-Inin gegenüber den Hundezelllinien. Wie erwartet waren Artemisinin und seine Derivate auch in diesen Tumorzelllinien aktiv. Die IC 50 -Werte für Artemisinin, Artesunat und Dihydroartemisinin gegenüber DH82-Zellen und DGBM-Zellen sind in 6 dargestellt.
Diskussion
Es wurde unter Tierärzten und Heilpraktikern diskutiert, ob eine Eisenergänzung für die Aktivität von Artemisinin vorteilhaft ist oder nicht. Die Rolle von Häm für die Antimalariaaktivität von Artemisinin und seinen Derivaten wurde diskutiert (57, 58). Im Zusammenhang mit Krebs haben wir zuvor berichtet, dass Ferrosanol® und Holotransferrin die Artesunat-induzierte Zytotoxizität und Apoptose bei Leukämie- und Astrozytomzellen um das 10-fache erhöhen. Diese Effekte wurden durch den monoklonalen Anti-TfR-Antikörper RVS10 umgekehrt, der mit Transferrin um die Bindung an TfR konkurriert. Während die TfR-Expression in Tumorzelllinien zwischen 48 und 95% lag, zeigten normale periphere mononukleäre Blutleukozyten eine TfR-Positivität von ≤ 1,3%, was darauf hinweist, dass Artesunat aufgrund der bevorzugten TfR-Expression in Tumorzellen zumindest teilweise tumorspezifische Wirkungen ausüben kann (59). In einer nachfolgenden Studie untersuchten wir insgesamt 36 Zelllinien verschiedener Tumortypen auf ihr Ansprechen auf die Behandlung mit Artesunat allein oder in Kombination mit Ferrosanol® (60). Dies zeigte, dass Artesunat plus Ferrosanol® die Zytotoxizität im Vergleich zu Artesunat allein in der Mehrzahl der Zelllinien erhöht; 11 Zelllinien zeigten jedoch keine erhöhte Apoptose und neun Linien zeigten nach der kombinierten medikamentösen Behandlung eine Abnahme der Apoptose im Vergleich zur Artesunat-Behandlung allein. Es versteht sich, dass Eisen als Co-Faktor für proliferationsbedingte Enzyme fungiert (61).
Daher kann Ferrosanol® die Proliferation dieser neun Zelllinien eher induzieren als unterdrücken. Auf der Basis dieser In-vitro-Daten kann nicht zuverlässig empfohlen werden, Eisen als Ergänzung zur Behandlung vom Artemisinin-Typ in der tierärztlichen oder menschlichen Krebstherapie zuzusetzen. Die Ergebnisse der vorliegenden Studie zeigten, dass der Eisengehalt im Blut nicht mit den Überlebenszeiten nach der A. annua-Therapie assoziiert war, während das beim TfR-Gehalt im Tumor der Fall war. Aus praktischen Gründen kann davon ausgegangen werden, dass der normale Eisengehalt des Körpers für die Aktivität von Artesunat ausreichend sein sollte. Nur bei Patienten mit Eisenmangel kann eine Eisenergänzung in Betracht gezogen werden. In diesem Fall kann es jedoch wichtig sein, dass Eisen und Artesunat gleichzeitig den Tumor erreichen, damit sich eine mögliche verstärkende Wirkung der Wirkstoffkombination entwickeln kann. Andernfalls kann Ferrosanol® schlechtere Wirkungen zeigen und eher zu einer Verstärkung als zu einer Unterdrückung der proliferativen Tumoraktivität führen.
Die Wirkung von Eisen wurde auch in anderen früheren Studien gezeigt. Es wurde berichtet, dass die Zugabe von Transferrin die Kreuzresistenz von multiresistenten H69VP-kleinzelligen Lungenkrebszellen gegen Artemisinin hemmen kann (62). Darüber hinaus sind Retinoblastomzellen mit hoher TfR-Expression im Vergleich zu normalen Retina-Zellen anfälliger für Artesunat. Diese Aktivität ist spezifisch, da ein durch RNA-Interferenz vermittelter TfR-Knockdown die Empfindlichkeit von Retinoblastomzellen gegenüber Artesunat erhöht (63). In Übereinstimmung mit diesen Befunden erhöht die Supplementation mit Holotransferrin die Zytotoxizität von Dihydroartemisinin in T-Zell-Lymphomzellen (64).
Es ist gut dokumentiert, dass TfR in Tumorzellen im Vergleich zu normalen Zellen stärker exprimiert wird (61,65-68). Daher wurden experimentelle Therapiestrategien vorgeschlagen, bei denen TfR das Behandlungsziel ist, um gleichzeitig die tumorspezifische Abtötung zu verbessern und toxische Nebenwirkungen auf normales Gewebe zu vermeiden, beispielsweise durch antikörpervermitteltes Targeting von TfR oder die Erzeugung von TfR – gerichteten Immuntoxine (69-71). Die Erzeugung von Transferrin-Artemisinin-Konjugaten zeigte im Vergleich zu ungekoppeltem Artemisinin eine erhöhte Zytotoxizität gegenüber Tumorzellen (72-74).
Zuvor führten wir eine klinische Phase I/II Studie mit Artesunat bei 23 krebskranken Hunden durch, bei der in 1 Fall eine vollständige Remission und in 7 Fällen eine stabile Erkrankung nach einer Artesunat-Behandlung festgestellt wurden (39). Die Ergebnisse der vorliegenden retrospektiven Studie mit A. annua scheinen verbessert zu sein. In der vorliegenden Studie wurde bei 9 von 25 Hunden (36%) eine Verlängerung der Überlebenszeit über die Schwelle von 18 Monaten festgestellt. Obwohl dieser Trend in zukünftigen Studien bestätigt werden muss, könnte spekuliert werden, dass die Antikrebswirkung des gesamten Pflanzenextrakts besser ist als die von isoliertem Artemisinin oder dem halbsynthetischen Derivat Artesunat. Tatsächlich enthält der Pflanzenextrakt neben Artemisinin (75-78) viel mehr zytotoxische Verbindungen, einschließlich Arteanuin B, Artemisiten, Scopoletin und 1,8-Cineol. Daher können A. annua-Präparate allein als Kombinationstherapie verwendet werden. Es können mehrere zytotoxische Verbindungen gleichzeitig gegen den Tumor wirken, was zu einer verbesserten Tumorhemmung führt.
Es ist bekannt, dass schnell proliferierende Tumoren besser auf eine Standardchemotherapie ansprechen als langsam wachsende Tumoren (79,80). Daher umfasste die vorliegende Studie auch Ki-67 als Proliferationsmarker in der immunhistochemischen Analyse. Ki-67 ist eng mit dem Zellzyklus verbunden. Seine Rolle als prädiktiver Faktor für den Erfolg der Chemotherapie und als prognostischer Faktor für das Überleben von Krebspatienten wird diskutiert (81,82). Daher zeigte der signifikante Zusammenhang zwischen der Ki-67-Expression und der Zytotoxizität gegenüber Artemisinin im Panel von 54 menschlichen Zelllinien aus acht verschiedenen Tumortypen, dass die Ki-67-Expression auch ein prognostischer Marker für die Tumorantwort auf Artemisinin sein könnte. Die vorliegende Studie zeigte eine signifikante Korrelation zwischen der TfR- und Ki-67-Expression in Veterinärtumoren und menschlichen Tumorzelllinien, was darauf hinweist, dass die TfR-Expression mit hohen Proliferationsraten verbunden ist und dass Artemisinin bei schnell wachsenden Tumoren aktiver ist als bei langsam wachsenden. Dieses Ergebnis stützt frühere Daten von menschlichen Tumoren und spricht auch für die Vergleichbarkeit von veterinärmedizinischen und menschlichen Tumoren in dieser Hinsicht. Von einer signifikanten Korrelation zwischen TfR und Ki-67-Expression wurde bei Biopsien verschiedener Tumortypen berichtet, darunter Leukämie, Melanom, Brustkarzinom, Hirntumoren, Kopf- und Halskrebs und Speiseröhrenkrebs (83-88). Obwohl im gesamten Panel von 54 Tumorzelllinien eine signifikante Assoziation zwischen TfR und Ki-67 festgestellt wurde, wurde diese Assoziation in der Mehrzahl der Untergruppen mit unterschiedlichen Tumortypen nicht beobachtet. Dies kann einfach durch die begrenzte Anzahl von Zelllinien pro Tumorentität erklärt werden. Die zuvor veröffentlichten Daten zur signifikanten Korrelation zwischen TfR- und Ki-67-Expression wurden anhand von größeren Kollektiven von Tumorbiopsien gesammelt (83,89).
In der menschlichen Tumorpathologie ist die Hämatoxylin- und Eosin-Färbung auch zum Nachweis von Tumor-infiltrierenden Lymphozyten nützlich ( TILs) (90-92). Daher haben wir in der vorliegenden Studie auch die mit Hämatoxylin und Eosin gefärbten Objektträger der Haustiertumoren auf das Vorhandensein von TILs untersucht, aber TILs konnten im Tumorgewebe nicht nachgewiesen werden. Da die Tumoren im Allgemeinen groß waren und bereits bei der Diagnose ein fortgeschrittenes Stadium erreicht hatten, wurde angenommen, dass das Immunsystem der Tiere geschwächt war und die TIL-vermittelte Immunabwehr gegen den Tumor weitgehend zerstört war.
Darüber hinaus ist zu erwähnen, dass in der vorliegenden Studie keine wesentlichen Nebenwirkungen bei den mit 25 A. annua behandelten Hunden und Katzen beobachtet wurden. Im Vergleich zur Tumorbehandlung bei menschlichen Krebspatienten mit dem halbsynthetischen Medikament Artesunat schien A. annua noch sicherer zu sein. Unter den 23 mit Artesunat behandelten Hunden mit Krebs wurde bei 16 Hunden Fieber und vorübergehende hämatologische und gastrointestinale Toxizität beobachtet, und 1 Hund starb an einer Lungenentzündung (39). Bei menschlichen Krebspatienten wurde die Härtefallanwendung von A. annua bei 1 Patienten mit Prostatakarzinom in einer früheren Studie gut vertragen (41). Es wurde berichtet, dass die Behandlung mit Artesunat zu gelegentlichen und vorübergehenden Nebenwirkungen führt, einschließlich hämatologischer Toxizität, gastrointestinaler Toxizität, Asthenie und Thrombose bei Dickdarm-, Gebärmutterhals- und Brustkarzinomen (42-44). In seltenen Fällen wurde von Hepatotoxizität mit Artesunat berichtet (93,94). Ob phytotherapeutische Ansätze mit A. annua sicherer sind als die Behandlung mit Artesunat, muss weiter untersucht werden.
Insbesondere berichtete die Mehrheit der Tierhalter, dass sich die Tiere nach der Behandlung mit A. annua besser zu fühlen schienen; Einige waren aktiver, während andere entspannter waren. Natürlich sind diese Beobachtungen subjektiv und nicht quantifizierbar, und es ist unklar, ob diese Berichte den psychischen Zustand des Tierbesitzers nach erfolgreicher Behandlung seiner Haustiere widerspiegeln können. Diese Beobachtung sollte jedoch nicht vernachlässigt werden, da nicht ausgeschlossen werden kann, dass eine unerwartete und unbeabsichtigte positive Nebenwirkung der A. annua-Behandlung vorliegt. In der Tat gibt es einige frühere Studien, die diese Beobachtungen stützen. Es wurde berichtet, dass die Serotonin-Serumspiegel im Gehirn von mit Artesunat behandelten Kaninchen im Vergleich zu unbehandelten Kontrolltieren signifikant höher sind (95). Zhu et al (96) berichteten über signifikante Remissionen bei nozizeptivem, verängstigtem und depressivem Verhalten durch Dihydroartemisinin, Artesunat oder Artemether. Amos et al. (97) wiesen auf sedierende Eigenschaften von Artemisinin hin, die durch die Wirkung von Artemisinin auf postsynaptische Dopamin-D2-Rezeptoren im Gehirn vermittelt werden. Dieser neuartige Aspekt der möglichen Aktivität von Artemisinin verdient in Zukunft weitere detaillierte Untersuchungen. Die vorliegende Untersuchung wirft auch die allgemeinere Frage nach der Vergleichbarkeit der bei Veterinärtumoren erhobenen Daten mit der klinischen Situation bei menschlichen Tumoren und damit der Eignung von Veterinärtumoren als Modelle für die Biologie und Behandlung von Krebs beim Menschen auf. Die vorliegende Studie stellte fest, dass die Rolle von TfR und Ki-67 zwischen Veterinärtumoren und menschlichen Tumorzelllinien vergleichbar war. TfR und Ki-67 wurden auch mit der Reaktion auf Artemisinin und Artesunat bei Tumoren menschlicher Patienten in Verbindung gebracht (41-43). Obwohl diese Daten bei menschlichen Tumoren noch nicht verifiziert wurden, weisen sie darauf hin, dass veterinärmedizinische Tumoren im Rahmen der Artemisinin-Therapie ein geeignetes Modell für klinische menschliche Tumoren darstellen können.
Unabhängig von dieser Situation gibt es weitere Argumente, die die Eignung von Veterinärtumoren für die Untersuchung der menschlichen Krebsbiologie unterstützen. Veterinärtumoren entwickeln sich spontan, was sie im Vergleich zu anderen Tumoren bei Mäusen und Ratten als bessere Modelle qualifizieren kann. Häufig werden Tumore aufrechterhalten, indem syngene Tumoren auf Nagetiere oder humane Xenotransplantat-Tumoren in immunsupprimierte Nacktmäuse transplantiert werden. Eine andere Möglichkeit besteht darin, die Tumorentwicklung bei Mäusen oder Ratten durch chemische Karzinogene zu induzieren. Obwohl diese Tumormodelle in der präklinischen Onkologie unverzichtbar und von hohem Wert sind, sind sie bis zu einem gewissen Grad künstlich. Hier können Tumoren bei Hunden und Katzen vorteilhaft sein, da ihre spontane Entwicklung näher an der Situation menschlicher Tumoren liegt. Veterinärtumoren haben bisher nicht so viel Aufmerksamkeit erhalten wie die oben genannten Nagetier-Tumormodelle. Weitere Untersuchungen sind erforderlich, um das volle Potenzial von Veterinärtumoren als attraktive In-vivo-Modelle für die Entwicklung von Strategien zur Behandlung von Tumoren beim Menschen zu untersuchen.
Zusammenfassend lässt sich sagen, dass bei der aktuellen retrospektiven Studie mit 20 Hunden und Katzen, die mit einer Standardtherapie in Kombination mit A. annua behandelt wurden, und 11 Hunden, die nur mit einer Standardtherapie behandelt wurden, eine zusätzliche Nahrungsergänzung mit A. annua bei Veterinärkrebspatienten zu einer verbesserten Überlebensprognose führte. Die Aktivität von A. annua hängt möglicherweise vom Eisengehalt im Tumor, jedoch nicht im Blut ab, da die TfR-Expression in den Tumoren signifikant mit der Überlebenszeit und der Artemisinin-Zytotoxizität in einem Kontrollpanel menschlicher Tumorzelllinien korrelierte. Gleiches gilt für den Ki-67-Ausdruck. Tumoren mit hoher Ki-67-Expression, die auf eine hohe proliferative Aktivität hinweisen, waren im Panel menschlicher Zelllinien anfälliger für Artemisinin.
Die in der vorliegenden Studie präsentierten Daten sollten Hinweise für die Aktivität von A. annua gegen Veterinärtumoren geben. Prospektive Studien sind erforderlich, um überzeugende Beweise für diese Hypothese zu liefern.
Danksagung
Die Autoren möchten Frau Doris Rohr (Abteilung für Pharmazeutische Biologie, Institut für Pharmazie und Biochemie, Universität Johannes Gutenberg, Mainz, Deutschland) für die technische Unterstützung bei der Färbung der Immunhistochemie danken.
Finanzierung
Diese Studie wurde durch eine intramurale Finanzierung der Johannes Gutenberg-Universität (Mainz, Deutschland) unterstützt.
Verfügbarkeit von Daten und Materialien
Die während der aktuellen Studie generierten und / oder analysierten Datensätze sind aufgrund von Einschränkungen der Verfügbarkeit dieser Daten nicht öffentlich verfügbar, aber vom entsprechenden Autor auf begründete Anfrage verfügbar.
Autorenbeiträge
Thomas Efferth und Elmar Breuer haben die Studie entworfen. Elmar Breuer behandelte die Tiere, stellte das Material zur Verfügung und sammelte die klinischen Daten. MOHAMED E.M. SAEED führte die Immunfärbung durch. MOHAMED‑ELAMIR F. HEGAZY führte NMR und HPLC-MS durch. TE führte die statistische Analyse durch, überwachte die Arbeit und stellte die Einrichtungen für die Studie bereit. Thomas Efferth und MOHAMED E.M. SAEED haben das Manuskript geschrieben. Alle Autoren haben das Manuskript gelesen und die endgültige Fassung genehmigt.
Die schriftliche Genehmigung für diese retrospektive Studie wurde vom Regierungspräsidium Freiburg (Az. 35-9185.81 / 1 vom 4. Februar 2019) eingeholt. Die schriftliche Einverständniserklärung für experimentelle Arbeiten wurde von allen Tierbesitzern eingeholt.
Nicht anwendbar
Konkurrierende Interessen
EB handelt kommerziell mit LupArte®.
Kein Teil der experimentellen Arbeit am Institut für Pharmakologische Biologie (Johannes Gutenberg-Universität Mainz) wurde von EB finanziert.
Alle anderen Autoren erklären, dass sie keine konkurrierenden Interessen haben.
Referenzen
1. Talmadge JE, Singh RK, Fidler IJ and Raz A: Murine models to evaluate novel and conventional therapeutic strategies for cancer. Am J Pathol 170: 793‑804, 2007.
2. Jantscheff P, Beshay J, Lemarchand T, Obodozie C, Schächtele C and Weber H: Mouse‑derived isograft (MDI) in vivo tumor models I. Spontaneous sMDI models: Characterization and cancer therapeutic approaches. Cancers (Basel) 11: 11, 2019.
3. Choi JW, Yoon HY and Jeong SW: Clinical outcomes of surgically managed spontaneous tumors in 114 client‑owned dogs. Immune Netw 16: 116‑125, 2016.
4. Hellmén E, Bergström R, Holmberg L, Spångberg IB, Hansson K and Lindgren A: Prognostic factors in canine mammary tumors: A multivariate study of 202 consecutive cases. Vet Pathol 30: 20‑27, 1993.
5. Marconato L: The staging and treatment of multicentric high‑grade lymphoma in dogs: A review of recent developments and future prospects. Vet J 188: 34‑38, 2011.
6. Tuohy JL, Selmic LE, Worley DR, Ehrhart NP and Withrow SJ: Outcome following curative‑intent surgery for oral melanoma in dogs: 70 cases (1998‑2011). J Am Vet Med Assoc 245: 1266‑1273, 2014.
7. Miller RL, Van Lelyveld S, Warland J, Dobson JM and Foale RD: A retrospective review of treatment and response of high‑risk mast cell tumours in dogs. Vet Comp Oncol 14: 361‑370, 2016.
8. Romano FR, Heinze CR, Barber LG, Mason JB and Freeman LM: Association between body condition score and cancer prognosis in dogs with lymphoma and osteosarcoma. J Vet Intern Med 30: 1179 ‑1186, 2 016.
9. Sarowitz BN, Davis GJ and Kim S: Outcome and prognostic factors following curative‑intent surgery for oral tumours in dogs: 234 cases (2004 to 2014). J Small Anim Pract 58: 146‑153, 2 017.
10. Ettinger SN: Principles of treatment for feline lymphoma. Clin Tech Small Anim Pract 18: 98‑102, 2003. 11. Morris J: Mammary tumours in the cat: Size matters, so early intervention saves lives. J Feline Med Surg 15: 391‑400, 2013.
12. Zabielska‑Koczywąs K, Wojtalewicz A and Lechowski R: Current knowledge on feline injection‑site sarcoma treatment. Acta Vet Scand 59: 47, 2017.
13. Martano M, Iussich S, Morello E and Buracco P: Canine oral fibrosarcoma: Changes in prognosis over the last 30 years? Vet J 241: 1‑7, 2018.
14. Zhang D, Hedlund EM, Lim S, Chen F, Zhang Y, Sun B and Cao Y: Antiangiogenic agents significantly improve survival in tumor‑bearing mice by increasing tolerance to chemo‑therapy‑induced toxicity. Proc Natl Acad Sci USA 108: 4117‑4122, 2 011.
15. Tiwari A, Hadley JA, Hendricks GL III, Elkin RG, Cooper T and Ramachandran R: Characterization of ascites‑derived ovarian tumor cells from spontaneously occurring ovarian tumors of the chicken: Evidence for E‑cadherin upregulation. PLoS One 8: e57582, 2013.
16. Newman DJ and Cragg GM: Natural products as sources of new drugs from 1981 to 2014. J Nat Prod 79: 629‑661, 2016.
17. Tu Y: The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine. Nat Med 17: 1217‑1220, 2011.
18. Bridgford JL, Xie SC, Cobbold SA, Pasaje CFA, Herrmann S, Yang T, Gillett DL, Dick LR, Ralph SA, Dogovski C, et al: Artemisinin kills malaria parasites by damaging proteins and inhibiting the proteasome. Nat Commun 9: 3801, 2018.
19. Su XZ and Miller LH: The discovery of artemisinin and the Nobel Prize in Physiology or Medicine. Sci China Life Sci 58: 1175 ‑1179, 2 015.
20. Tu Y: Artemisinin‑a gift from traditional chinese medicine to the world (Nobel Lecture). Angew Chem Int Ed Engl 55: 10210‑10226, 2016.
21. Daddy NB, Kalisya LM, Bagire PG, Watt RL, Towler MJ and Weathers PJ: Artemisia annua dried leaf tablets treated malaria resistant to ACT and i.v. artesunate: Case reports. Phytomedicine 32: 3 7‑ 4 0, 2 017.
22. Saeed ME, Krishna S, Greten HJ, Kremsner PG and Efferth T: Antischistosomal activity of artemisinin derivatives in vivo and in patients. Pharmacol Res 110: 216‑226, 2016.
23. Pérez del Villar L, Burguillo FJ, López‑Abán J and Muro A: Systematic review and meta‑analysis of artemisinin based therapies for the treatment and prevention of schistosomiasis. PLoS One 7: e45867, 2012.
24. Naß J and Efferth T: The activity of Artemisia spp. and their constituents against Trypanosomiasis. Phytomedicine 47: 184‑191, 2018.
25. Efferth T: Beyond malaria: The inhibition of viruses by arte‑misinin‑type compounds. Biotechnol Adv 36: 1730‑1737, 2018.
26. Jiang W, Cen Y, Song Y, Li P, Qin R, Liu C, Zhao Y, Zheng J and Zhou H: Artesunate attenuated progression of atherosclerosis lesion formation alone or combined with rosuvastatin through inhibition of pro‑inflammatory cytokines and pro‑inflammatory chemokines. Phytomedicine 23: 1259‑1266, 2016.
27. Li J, Casteels T, Frogne T, Ingvorsen C, Honore C, Courtney M, Huber KV, Schmitner N, Kimmel RA, Romanov RA, et al: Artemisinins target GABAA receptor signaling and impair alpha cell Identity. Cell 168: 86‑100.e15, 2017.
28. Guo Y, Fu W, Xin Y, Bai J, Peng H, Fu L, Liu J, Li L, Ma Y and Jiang H: Antidiabetic and antiobesity effects of artemether in db/db mice. BioMed Res Int 2018: 8639523, 2018.
29. Efferth T, Dunstan H, Sauerbrey A, Miyachi H and Chitambar CR: The anti‑malarial artesunate is also active against cancer. Int J Oncol 18: 767‑773, 2001.
30. Efferth T, Sauerbrey A, Olbrich A, Gebhart E, Rauch P, Weber HO, Hengstler JG, Halatsch ME, Volm M, Tew KD, et al: Molecular modes of action of artesunate in tumor cell lines. Mol Pharmacol 64: 382‑394, 2003.
31. Dell’Eva R, Pfeffer U, Vené R, Anfosso L, Forlani A, Albini A and Efferth T: Inhibition of angiogenesis in vivo and growth of Kaposi’s sarcoma xenograft tumors by the anti‑malarial arte‑sunate. Biochem Pharmacol 68: 2359‑2366, 2004.
32. Efferth T: From ancient herb to modern drug: Artemisia annuaand artemisinin for cancer therapy. Semin Cancer Biol 46: 65‑83, 2 017.
33. Abba ML, Patil N, Leupold JH, Saeed ME, Efferth T and Allgayer H: Prevention of carcinogenesis and metastasis by Artemisinin‑type drugs. Cancer Lett 429: 11‑18, 2018.
34. Krusche B, Arend J and Efferth T: Synergistic inhibition of angiogenesis by artesunate and captopril in vitro and in vivo. Evid Based Complement Alternat Med 2013: 454783, 2013.
35. Efferth T: Cancer combination therapy of the sesquiterpenoid artesunate and the selective EGFR‑tyrosine kinase inhibitor erlotinib. Phytomedicine 37: 58‑61, 2017.
36. Efferth T: Cancer combination therapies with artemisinin‑type drugs. Biochem Pharmacol 139: 56‑70, 2017.
37. Hosoya K, Murahari S, Laio A, London CA, Couto CG and Kisseberth WC: Biological activity of dihydroartemisinin in canine osteosarcoma cell lines. Am J Vet Res 69: 519‑526, 2008.
38. Hosoya K, Couto CG, London CA, Kisseberth WC, Phelps MA and Dalton JT: Comparison of high‑dose intermittent and low‑dose continuous oral artemisinin in dogs with naturally occurring tumors. J Am Anim Hosp Assoc 50: 390‑395, 2014.
39. Rutteman GR, Erich SA, Mol JA, Spee B, Grinwis GC, Fleckenstein L, London CA and Efferth T: Safety and efficacy field study of artesunate for dogs with non‑resectable tumours. Anticancer Res 33: 1819‑1827, 2013.
40. Berger TG, Dieckmann D, Efferth T, Schultz ES, Funk JO, Baur A and Schuler G: Artesunate in the treatment of metastatic uveal melanoma ‑ first experiences. Oncol Rep 14: 1599‑1603, 20 05.
41. Michaelsen FW, Saeed ME, Schwarzkopf J and Efferth T: Activity of Artemisia annua and artemisinin derivatives, in prostate carcinoma. Phytomedicine 22: 1223‑1231, 2015.
42. Jansen FH, Adoubi I, JC KC, DE Cnodder T, Jansen N, Tschulakow A and Efferth T: First study of oral Artenimol‑R in advanced cervical cancer: Clinical benefit, tolerability and tumor markers. Anticancer Res 31: 4417‑4422, 2011.
43. Krishna S, Ganapathi S, Ster IC, Saeed ME, Cowan M, Finlayson C, Kovacsevics H, Jansen H, Kremsner PG, Efferth T, et al: A randomised, double blind, placebo‑controlled pilot study of oral artesunate therapy for colorectal cancer. EBioMedicine 2: 82‑90, 2014.
44. von Hagens C, Walter‑Sack I, Goeckenjan M, Osburg J, Storch‑Hagenlocher B, Sertel S, Elsässer M, Remppis BA, Edler L, Munzinger J, et al: Prospective open uncontrolled phase I study to define a well‑tolerated dose of oral artesunate as add‑on therapy in patients with metastatic breast cancer (ARTIC M33/2). Breast Cancer Res Treat 164: 359‑369, 2017.
45. Breuer E and Efferth T: Treatment of iron‑loaded veterinary sarcoma by Artemisia annua. Nat Prod Bioprospect 4: 113‑118, 2014.
46. Hegazy MF, Abdelfatah S, Hamed AR, Mohamed TA, Elshamy AA, Saleh IA, Reda EH, Abdel‑Azim NS, Shams KA, Sakr M, et al: Cytotoxicity of 40 Egyptian plant extracts targeting mechanisms of drug‑resistant cancer cells. Phytomedicine 59: 152771, 2019.
47. Chikazawa S, Hori Y, Kanai K, Ito N, Hoshi F, Orino K, Watanabe K and Higuchi S: Factors influencing measurement of serum iron concentration in dogs: Diurnal variation and hyper‑ferritinemia. J Vet Med Sci 75: 1615‑1618, 2013.
48. Carpenter CE and Ward RE: Iron determination by Ferrozine method. In: Food Analysis Laboratory Manual. Springer, Luxembourg, pp157‑159, 2017.
49. Stoica G, Lungu G, Martini‑Stoica H, Waghela S, Levine J and Smith R III: Identification of cancer stem cells in dog glio‑blastoma. Vet Pathol 46: 391‑406, 2009.
50. Wellman ML, Krakowka S, Jacobs RM and Kociba GJ: A macrophage‑monocyte cell line from a dog with malignant histiocytosis. In Vitro Cell Dev Biol 24: 223‑229, 1988.
51. Alley MC, Scudiero DA, Monks A, Hursey ML, Czerwinski MJ, Fine DL, Abbott BJ, Mayo JG, Shoemaker RH and Boyd MR: Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Res 48: 589 ‑ 6 01, 1988.
52. Rubinstein LV, Shoemaker RH, Paull KD, Simon RM, Tosini S, Skehan P, Scudiero DA, Monks A and Boyd MR: Comparison of in vitro anticancer‑drug‑screening data generated with a tetra‑zolium assay versus a protein assay against a diverse panel of human tumor cell lines. J Natl Cancer Inst 82: 1113‑1118, 1990.
53. Kuete V, Mbaveng AT, Sandjo LP, Zeino M and Efferth T: Cytotoxicity and mode of action of a naturally occurring naphthoquinone, 2‑acetyl‑7‑methoxynaphtho[2,3‑b]furan‑4,9‑quinone towards multi‑factorial drug‑resistant cancer cells. Phytomedicine 33: 62‑68, 2 017.
54. O’Brien J, Wilson I, Orton T and Pognan F: Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell cytotoxicity. Eur J Biochem 267: 5421‑5426, 2000.
55. Saeed ME, Mertens R, Handgretinger R and Efferth T: Identification of fatal outcome in a childhood nasopharyngeal carcinoma patient by protein expression profiling. Int J Oncol 53: 1721‑1731, 2018.
56. Blaskó G, Cordell GA and Lankin DC: Definitive 1H‑and 13C‑NMR assignments of artemisinin (Qinghaosu). J Nat Prod 51: 1273‑1276, 1988.
57. Haynes RK, Cheu KW, N’Da D, Coghi P and Monti D: Considerations on the mechanism of action of artemisinin anti‑malarials: Part 1 ‑ the ‘carbon radical’ and ‘heme’ hypotheses. Infect Disord Drug Targets 13: 217‑277, 2013.
58. Klonis N, Creek DJ and Tilley L: Iron and heme metabolism in Plasmodium falciparum and the mechanism of action of arte‑misinins. Curr Opin Microbiol 16: 722‑727, 2013.
59. Efferth T, Benakis A, Romero MR, Tomicic M, Rauh R, Steinbach D, Häfer R, Stamminger T, Oesch F, Kaina B, et al: Enhancement of cytotoxicity of artemisinins toward cancer cells by ferrous iron. Free Radic Biol Med 37: 998‑1009, 2004.
60. Kelter G, Steinbach D, Konkimalla VB, Tahara T, Taketani S, Fiebig HH and Efferth T: Role of transferrin receptor and the ABC transporters ABCB6 and ABCB7 for resistance and differ‑entiation of tumor cells towards artesunate. PLoS One 2: e798, 2 0 0 7.
61. Aulbert E, Disselhoff W, Sörje H, Schulz E and Gericke D: Lysosomal accumulation of 67Ga ‑ transferrin in malignant tumors in relation to their growth rate. Eur J Cancer 16: 1217‑1232, 1980.
62. Sadava D, Phillips T, Lin C and Kane SE: Transferrin overcomes drug resistance to artemisinin in human small‑cell lung carcinoma cells. Cancer Lett 179: 151‑156, 2002.
63. Zhao F, Wang H, Kunda P, Chen X, Liu QL and Liu T: Artesunate exerts specific cytotoxicity in retinoblastoma cells via CD71. Oncol Rep 30: 1473‑1482, 2013.
64. Wang Q, Wu S, Zhao X, Zhao C, Zhao H and Huo L: Mechanisms of dihydroartemisinin and dihydroartemisinin/holotransferrin cytotoxicity in t‑cell lymphoma cells. PLoS One 10: e0137331, 2015.
65. Judd W, Poodry CA and Strominger JL: Novel surface antigen expressed on dividing cells but absent from nondividing cells. J Exp Med 152: 1430‑1435, 1980.
66. Sutherland R, Delia D, Schneider C, Newman R, Kemshead J and Greaves M: Ubiquitous cell‑surface glycoprotein on tumor cells is proliferation‑associated receptor for transferrin. Proc Natl Acad Sci USA 78: 4515‑4519, 1981.
67. Trowbridge IS and Omary MB: Human cell surface glycoprotein related to cell proliferation is the receptor for transferrin. Proc Natl Acad Sci USA 78: 3039‑3043, 1981.
68. Gatter KC, Brown G, Trowbridge IS, Woolston RE and Mason DY: Transferrin receptors in human tissues: Their distri‑bution and possible clinical relevance. J Clin Pathol 36: 539‑545, 1983.
69. Tortorella S and Karagiannis TC: Transferrin receptor‑mediated endocytosis: A useful target for cancer therapy. J Membr Biol 247: 291‑307, 2014.
70. Luria‑Pérez R, Helguera G and Rodríguez JA: Antibody‑mediated targeting of the transferrin receptor in cancer cells. Bol Méd Hosp Infant México 73: 372‑379, 2016. SAEEDet al: Artemisia annua AGAINST SMALL PET TUMORS16
71. Akbari B, Farajnia S, Ahdi Khosroshahi S, Safari F, Yousefi M, Dariushnejad H and Rahbarnia L: Immunotoxins in cancer therapy: Review and update. Int Rev Immunol 36: 207‑219, 2017.
72. Lai H, Sasaki T, Singh NP and Messay A: Effects of arte‑misinin‑tagged holotransferrin on cancer cells. Life Sci 76: 1267‑1279, 2005.
73. Nakase I, Gallis B, Takatani‑Nakase T, Oh S, Lacoste E, Singh NP, Goodlett DR, Tanaka S, Futaki S, Lai H, et al: Transferrin receptor‑dependent cytotoxicity of artemisinin‑transferrin conjugates on prostate cancer cells and induction of apoptosis. Cancer Lett 274: 290‑298, 2009.
74. Gong Y, Gallis BM, Goodlett DR, Yang Y, Lu H, Lacoste E, Lai H and Sasaki T: Effects of transferrin conjugates of artemisinin and artemisinin dimer on breast cancer cell lines. Anticancer Res 33: 123‑132, 2013.
75. Zhong YR: Chemical constituents of volatile oils of Artemisia annua. Zhong Yao Tong Bao 8: 31‑32, 1983 (In Chinese).
76. Liao HW, Wang DY and Li XM: Studies on the chemical constituents of essential oil of Hunan Artemisia annua. Zhong Yao Cai 29: 562‑564, 2006 (In Chinese).
77. Efferth T, Herrmann F, Tahrani A and Wink M: Cytotoxic activity of secondary metabolites derived from Artemisia annua L. towards cancer cells in comparison to its designated active constituent artemisinin. Phytomedicine 18: 959‑969, 2011.
78. Zhang X, Zhao Y, Guo L, Qiu Z, Huang L and Qu X: Differences in chemical constituents of Artemisia annua L. from different geographical regions in China. PLoS One 12: e0183047, 2017.
79. Efferth T, Konkimalla VB, Wang YF, Sauerbrey A, Meinhardt S, Zintl F, Mattern J and Volm M: Prediction of broad spectrum resistance of tumors towards anticancer drugs. Clin Cancer Res 14: 2405‑2412, 2008.
80. Volm M and Efferth T: Prediction of cancer drug resistance and implications for personalized medicine. Front Oncol 5: 282, 2015.
81. Duffy MJ, Harbeck N, Nap M, Molina R, Nicolini A, Senkus E and Cardoso F: Clinical use of biomarkers in breast cancer: Updated guidelines from the European Group on Tumor Markers (EGTM). Eur J Cancer 75: 284‑298, 2017.
82. Sun X and Kaufman PD: Ki‑67: More than a proliferation marker. Chromosoma 127: 175‑186, 2018. 83. Scott CS, Ramsden W, Limbert HJ, Master PS and Roberts BE: Membrane transferrin receptor (TfR) and nuclear prolif‑eration‑associated Ki‑67 expression in hemopoietic malignancies. Leukemia 2: 438‑442, 1988.
84. Soyer HP, Smolle J, Smolle‑Juettner FM and Kerl H: Proliferation antigens in cutaneous melanocytic tumors ‑ an immunohisto‑chemical study comparing the transferrin receptor and the Ki‑67 antigen. Dermatologica 179: 3‑9, 1989.
85. Wrba F, Chott A, Reiner A, Reiner G, Markis‑Ritzinger E and Holzner JH: Ki‑67 immunoreactivity in breast carcinomas in relation to transferrin receptor expression, estrogen receptor status and morphological criteria. An immunohistochemical study. Oncology 46: 255‑259, 1989.
86. Prior R, Reifenberger G and Wechsler W: Transferrin receptor expression in tumours of the human nervous system: Relation to tumour type, grading and tumour growth fraction. Virchows Arch A Pathol Anat Histopathol 416: 491‑496, 1990.
87. Kearsley JH, Furlong KL, Cooke RA and Waters MJ: An immuno‑histochemical assessment of cellular proliferation markers in head and neck squamous cell cancers. Br J Cancer 61: 821‑827, 1990.
88. Chan KT, Choi MY, Lai KK, Tan W, Tung LN, Lam HY, Tong DK, Lee NP and Law S: Overexpression of transferrin receptor CD71 and its tumorigenic properties in esophageal squamous cell carcinoma. Oncol Rep 31: 1296‑1304, 2014.
89. Motamedi M, Xu L and Elahi S: Correlation of transferrin receptor (CD71) with Ki67 expression on stimulated human and mouse T cells: The kinetics of expression of T cell activation markers. J Immunol Methods 437: 43‑52, 2016.
90. Darb‑Esfahani S, Kolaschinski I, Trillsch F, Mahner S, Concin N, Vergote I, Van Nieuwenhuysen E, Achimas‑Cadariu P, Glajzer J, Woopen H, et al: Morphology and tumour‑infiltrating lymphocytes in high‑stage, high‑grade serous ovarian carcinoma correlated with long‑term survival. Histopathology 73: 1002‑1012, 2018.
91. Lee JS, Won HS, Sun S, Hong JH and Ko YH: Prognostic role of tumor‑infiltrating lymphocytes in gastric cancer: A systematic review and meta‑analysis. Medicine (Baltimore) 97: e11769, 2018.
92. Shen M, Wang J and Ren X: New insights into tumor‑infiltrating B lymphocytes in breast cancer: Clinical impacts and regulatory mechanisms. Front Immunol 9: 470, 2018.
93. Uhl M, Schwab S and Efferth T: Fatal liver and bone marrow toxicity by combination treatment of dichloroacetate and arte‑sunate in a glioblastoma multiforme patient: Case report and review of the literature. Front Oncol 6: 204, 2016.
94. Efferth T, Schöttler U, Krishna S, Schmiedek P, Wenz F and Giordano FA: Answer to the comment of Hai Lu et al. regarding ‘Hepatotoxicity by combination treatment of temozolomide, artesunate and Chinese herbs in a glioblastoma multiforme patient: Case report and review of the literature. Arch Toxicol (2016)’. Arch Toxicol 91: 2491‑2492, 2017.
95. Eigbibhalu UG, Albert Taiwo EO, Douglass IA and Abimbola EA: Effect of selected anti‑malarial drugs on the blood chemistry and brain serotonin levels in male rabbits. Pak J Pharm Sci 26: 125‑129, 2013.
96. Zhu CY, Xu QH, Mao ZY and Lin N: Application of three arte‑misinin derivatives in neuropathic pain: Evaluating co‑curation of nociceptive and emotional syndromes in spinal cord ligation mice. Zhongguo Zhong Yao Za Zhi 43: 3058‑3063, 2018 (In Chinese).
97. Amos S, Chindo BA, Abbah J, Vongtau HO, Edmond I, Binda L, Akah PA, Wambebe C and Gamaniel KS: Postsynaptic dopamine (D(2))‑mediated behavioural effects of high acute doses of arte‑misinin in rodents. Brain Res Bull 62: 255‑260, 2003.
This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) License.